Необычный клинический случай местнораспространенного рака желудка
В стационар поступила пожилая женщина с симптомами тревоги
По материалам:A multidisciplinary approach to an unusual medical case of locally advanced gastric cancer: a case report
Nicola Carlomagno, Fabrizio Schonauer, Vincenzo Tammaro, Annalena Di Martino, Carmen Criscitiello, Michele L. Santangelo
Journal of Medical Case Reports 2015, 9:13
81‑летняя женщина поступила в терапевтическое отделение с жалобами на общую слабость, потерю веса, рвоту и боли в животе. В анамнезе: гипертоническая болезнь и холецистэктомия по поводу острого холецистита. При осмотре обнаружена припухлость на передней брюшной стенке, высказано предположение о послеоперационной грыже. Однако при эндоскопическом исследовании выявлена опухоль антрального отдела желудка. В следующие несколько дней над описанной припухлостью образовалась сначала небольшая кожная язва, а затем сформировался свищ. Пациентка была переведена в хирургическое отделение.
Для справки
Пан-цитокератин (общий цитокератин, цитокератин АЕ1/АЕ3) — смесь моноклональных антител к различным цитокератинам, белкам цитоскелета эпителиальных клеток. Используется для дифференциальной диагностики рака и неэпителиальных опухолей.
Хромогранин А содержится в гранулах большинства нейроэндокринных клеток. Специфичный маркер нейроэндокринных опухолей разного происхождения.
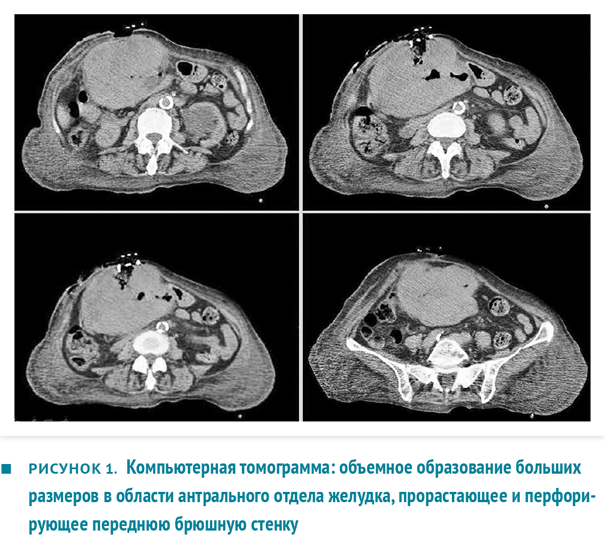
При лабораторном исследовании выявлены гипопротеинемия 46 г/л, гипоальбуминемия 20 г/л и анемия (гемоглобин 83 г/л). При выполнении компьютерной томографии (КТ) описано массивное образование 10×14×15 см в области антрума с центральным некрозом и кровоизлияниями, со слабой васкуляризацией, без четкой границы с левой долей печени (рис. 1). Опухолевая масса врастала в поперечную ободочную кишку и прямую мышцу живота, занимала значительную часть верхнего этажа брюшной полости и формировала наружный свищ. При КТ-исследовании не обнаружено метастазов.
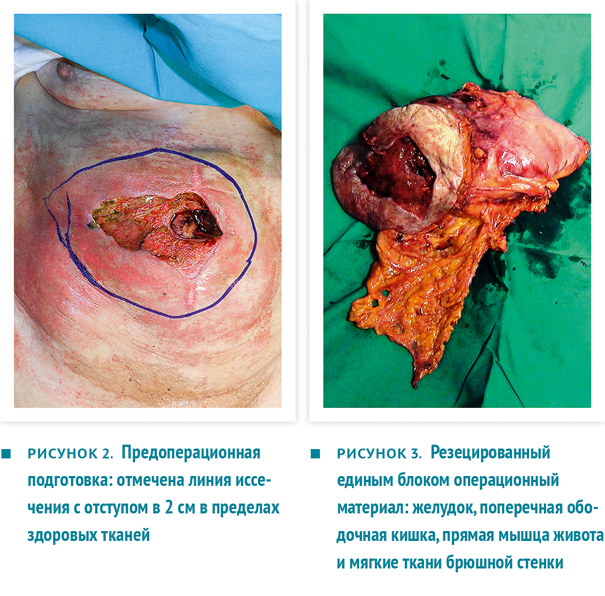
Проведено хирургическое лечение. Вокруг неопластического поражения выполнен эллиптический разрез в пределах 2 см здоровых тканей (рис. 2). Боковые края расширены линейными разрезами.
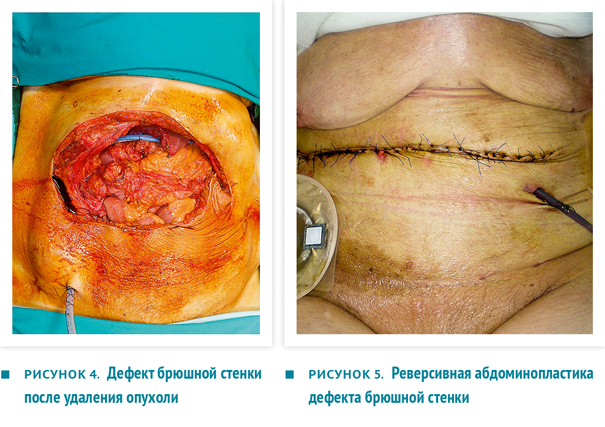
Единым блоком резецированы участок передней брюшной стенки, часть желудка и часть ободочной кишки (рис. 3), проведена систематическая лимфодиссекция, после чего наложен аппаратный гастроеюноанастомоз и ручной тонко-толстокишечный анастомоз. Установлены 2 внутрибрюшных дренажа (рис. 4).
Дефект передней брюшной стенки протезирован сетчатым трансплантатом, рана закрыта методом реверсивной абдоминопластики (рис. 5). Внутрибрюшное давление в ходе оперативного вмешательства и в послеоперационном периоде было
ниже 10 мм. рт. ст.
Для справки
CD56 — молекула клеточной адгезии, в норме экспрессируется на поверхности натуральных киллеров, нейронов, клеток глии, скелетных мышц. Определяется на клетках многих солидных и гематологических опухолей.
Виментин — белок цитоскелета клеток мезодермального происхождения, в частности соединительной ткани. Обнаруживают при фиброзных опухолях, саркомах, мезотелиоме.
Синаптофизин участвует в формировании синаптических пузырьков в нервных клетках. Маркер нейроэндокринных опухолей.
Белок S-100 — семейство кальций-связывающих белков, повышение концентрации наблюдается при прогрессии меланомы.
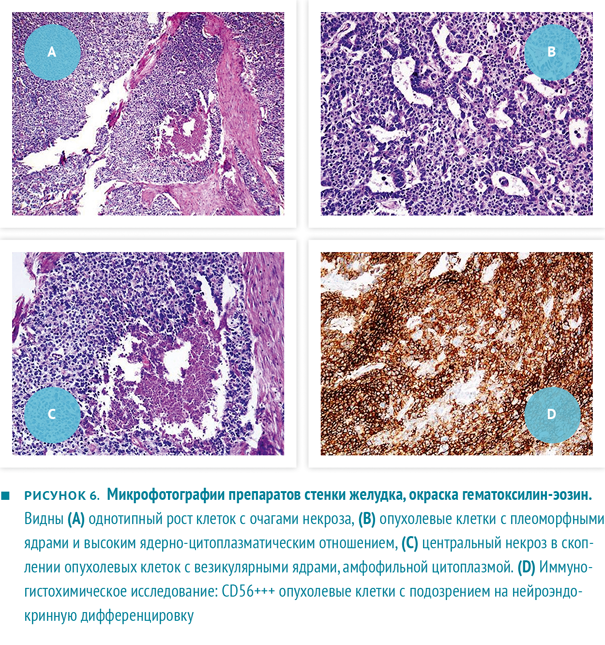
По данным гистологического исследования, удаленная опухоль соответствовала малодифференцированной аденокарциноме с чертами нейроэндокринной дифференцировки с прорастанием до слизистой оболочки поперечной ободочной кишки и мягких тканей до кожи (рис. 6а‑с). При иммуногистохимическом исследовании выявлено позитивное окрашивание к пан-цитокератину, хромогранину и CD56 (рис. 6d), негативное — к виментину, синаптофизину и S-100.
Состояние пациентки в раннем послеоперационном периоде было удовлетворительным. По поводу анемии легкой степени проведены гемотрансфузии в первые 3 дня. Активная перистальтика отмечена с 3‑го дня. С 6-го дня, после контрастного рентгенологического исследования верхних отделов ЖКТ, пациентка начала самостоятельно принимать пищу.
К сожалению, с 10‑го дня у пациентки на фоне пневмонии развился тяжелый респираторный дистресс-синдром. Несмотря на проводимую антибактериальную терапию и перевод в отделение интенсивной терапии, она умерла на 20‑й день после операции.
Обсуждение
Несмотря на то что рак желудка часто обнаруживают только на поздних стадиях [1, 2], прорастание опухолью брюшной стенки с ее деструкцией и формированием наружного желудочного свища встречается редко. Обычно поражение опухолевыми клетками ограничивается серозными оболочками и прилежащими тканями смежных органов [3]. В литературе описаны единичные случаи серьезного поражения кишечника при раке желудка и манифестации болезни с кишечной непроходимости [4–7], прямокишечного кровотечения, запоров и тенезмов [8]. Еще более редки случаи доминирования симптомов массивного прорастания брюшной стенки. Описан 62‑летний пациент с диффузной инвазией опухолевых клеток в переднюю брюшную стенку при раке желудка, однако без ее полного разрушения [9].
Ранее опубликованы случаи гастроинтестинальных стромальных опухолей желудка, достигавших гигантских размеров и отличавшихся быстрым ростом по сравнению со «средними» аденокарциномами [10, 11], но в данном случае описан ранее не представленный тип этой опухоли — нейроэндокринный.
В запущенных случаях рака желудка возможности терапии обычно ограничены неоадъювантной химиотерапией с гастростомией или еюностомией. В описанном случае подобная тактика была неприменима из‑за обширного дефекта брюшной стенки и вовлечения поперечной ободочной кишки. Было принято решение о резекции всех пораженных органов единым блоком.
При онкологических операциях во избежание контаминации опухолевыми клетками распространено широкое иссечение больших участков мягких тканей. Устранение кожного дефекта после оперативных вмешательств возможно пластикой на питающей ножке местными и отдаленными тканями, либо с переносом свободного кожного лоскута [1]. Для реконструкции дефекта верхней части передней брюшной стенки могут быть использованы кожно-мышечные лоскуты на основе прямой мышцы живота или широчайшей мышцы спины. При значительном поражении местных тканей может потребоваться свободная кожная пластика. Ее преимущество — лучший косметический эффект, а недостатки — более длительное время операции, возможность отторжения трансплантированного лоскута и большие повреждения донорского участка.
Альтернативой перечисленным методам может быть использованная в описанном случае реверсивная абдоминопластика [12]. Кожу нижнего края операционной раны вместе с поверхностной фасцией отделяют от мышечного футляра. Разрез продолжают до лобковой области, полученный лоскут подтягивают кверху для закрытия дефекта брюшной стенки. Реверсивная абдоминопластика чаще используется в пластической хирургии для коррекции формы живота после значительной потери веса [13, 14] и редко — для реконструктивных операций после резекции опухоли [15–17]. Она может быть использована в комбинации с другими типами лоскутов, а также для покрытия сетчатого эндопротеза.
Стоит отметить особо, что смерть пациентки наступила не из‑за хирургических осложнений. Внутрипузырное измерение внутрибрюшного давления рутинно проводили на всех этапах терапии, наиболее угрожаемых по развитию внутрибрюшной гипертензии и абдоминального компартмент-синдрома. Оперативное вмешательство проведено усилиями хирурга-онколога и пластического хирурга с применением адекватной техники. Авторы статьи убеждены в пользе и важности индивидуального подхода и нестандартных решений в сложных случаях хирургического вмешательства при онкологических заболеваниях.
4 февраля 2016
Текст: Егор Баторов (перевод)
Выпуск: №145, январь 2016 ВрачИсточник: jmedicalcasereports.com
7315 просмотров
7315 просмотров
Поделиться ссылкой с друзьями ВКонтакте Одноклассники
Нашли ошибку? Выделите текст и нажмите Ctrl+Enter.

 Катрен Стиль
Катрен Стиль
зарегистрированным пользователям