Хронический кашель является одной из частых причин обращения к врачу, а также за консультацией в аптеку. При этом, дифференциальный диагноз эозинофильного бронхита с классическим и кашлевым вариантом бронхиальной астмы представляет собой непростую задачу. Ученые-фармакологи продолжают активно работать над этой проблемой. Так, российские исследователи Б. А. Черняк, И. Н. Трофименко и И. И. Воржева провели анализ имеющейся литературы по этому вопросу и в 2023 году опубликовали работу «Эозинофильный бронхит как причина хронического кашля: диагностика и лечение». Публикация представляет собой практический интерес не только для врачей-клиницистов, но и для работников первого стола. Проведём её краткий обзор — надеемся, что изложенные в ней данные помогут нашим читателям актуализировать свои знания по указанному вопросу и пригодятся вам в работе.
Введение
По данным авторов работы, хронический кашель (ХК) остаётся одной из самых распространённых жалоб у пациентов, обращающихся за медицинской помощью [1, 2]. Установить причину ХК удаётся не всегда, а в 33–46 % она остаётся неуточненной [3–6].
Почти у половины всех пациентов с ХК отмечается эозинофильное воспаление нижних дыхательных путей (НДП) [7, 8]. Среди причин такого состояния чаще всего выступает классическая бронхиальная астма (КБА), кашлевой вариант бронхиальной астмы (КВБА) и эозинофильный бронхит (ЭБ), который часто обозначают как неастматический эозинофильный бронхит [8, 9].
Признаками ЭБ является эозинофилия в анализах мокроты при отсутствии бронхиальной гиперреактивности и обструктивных изменений по данным спирометрии, а также хороший эффект от лечения глюкокортикостероидами (ГКС) [10].
По данным научных исследований было выяснено, что эозинофильный бронхит является одной из ведущих причин хронического кашля, уступая по частоте только бронхиальной астме (БА) и хронической обструктивной болезни лёгких (ХОБЛ) [11, 12].
ЭБ является наиболее распространённой причиной (38 %) эозинофилии нижних дыхательных путей. Для сравнения: на долю ХОБЛ, БА и их сочетаний приходится соответственно 31 %, 11 % и 20 % случаев [12]. При этом высокий уровень эозинофилии в анализах мокроты сочетается с нормальным или незначительно повышенным уровнем эозинофилов в крови [11, 12].
Этиология и патогенез эозинофильного бронхита
Среди вероятных причин ЭБ [1] выделяют атопическую аллергию, экологические факторы, профессиональные вредности [7, 13, 14], а также влияние лекарственных средств (ЛС).
В литературе есть описание случаев ЭБ, связанных с приёмом буцилламина при ревматоидном артрите (РА), месалазина при язвенном колите и лефлуномида при лёгочном саркоидозе [15–17].
Когда причина не ясна, говорят об идиопатической форме заболевания. Авторы работы уточняют, что патогенез ЭБ связан с иммуноопосредованным хроническим эозинофильным воспалением Т2–типа [18–21].
Биопсия бронхов больных показывает, что эозинофильный бронхит и бронхиальная астма имеют как схожие черты [18, 20, 22, 23, 24, 25] эозинофильного воспаления, так и существенные различия в течении этого процесса [25, 26].
Основное отличие эозинофильного бронхита от астмы состоит в нормальной бронхиальной реактивности, которая обусловлена отсутствием или низким содержанием мастоцитов в гладкомышечной ткани НДП.
Что же тормозит поступление мастоцитов в гладкомышечную оболочку бронхов и развитие бронхоспазма? Авторы работы приводят данные о том, что это простагландин Е2, уровень которого у пациентов с эозинофильным бронхитом значительно выше, чем у пациентов с БА [29, 30].
Диагностика
Большинство случаев эозинофильного бронхита развивается в среднем возрасте в отсутствие курения, но есть описание дебюта болезни и у детей [31]. Хронический кашель при ЭБ имеет непродуктивный или малопродуктивный характер [8, 11].
В этом случае характерна эозинофилия нижних дыхательных путей, которая подтверждается анализами индуцированной мокроты [27]. Высокий уровень эозинофилии (>3 %) в мокроте сочетается с нормальным или незначительно повышенным содержанием эозинофилов в периферической крови.
По данным авторов, важно определить уровень FeNO у пациентов с ЭБ, так как он отличается меньшей чувствительностью и непостоянной величиной специфичности от аналогичного показателя у пациентов с классической бронхиальной астмой [32, 33].
Для эозинофилного бронхита характерно также отсутствие бронхообструкции, подтверждаемое нормальными показателями спирометрии. Отмечается эозинофильная инфильтрация слизистой бронхов в виде диффузных узелковых образований [34].
Основные критерии отличия ЭБ от КБА и КВБА можно увидеть в таблице, составленной авторами оригинального исследования [9, 30, 35, 36, 37, 38]:
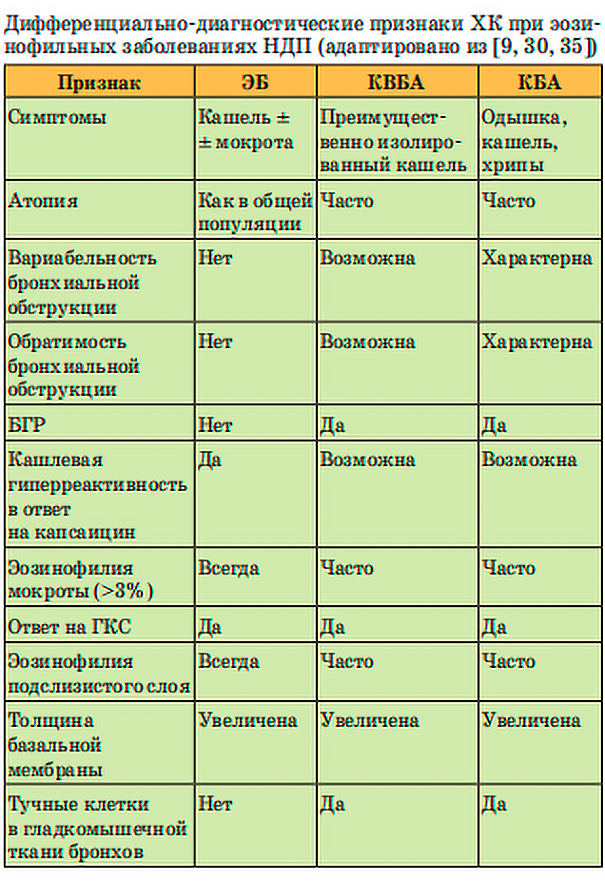
При компьютерной томографии (КТ) отмечаются сходные признаки поражения дистальных отделов НДП (центрилобулярные узелки и «воздушные ловушки»), что не даёт использовать лучевые методы для дифференциальной диагностики ЭБ и БА [1, 27, 39].
Таким образом авторы формулируют основные критерии диагноза эозинофильного пробнхита [8, 11]:
- непродуктивный или малопродуктивный ХК;
-
показатели спирометрии в пределах нормы;
-
отсутствие обратимости бронхиальной обструкции;
-
отрицательный бронхопровокационный тест с метахолином;
-
эозинофилия мокроты (>3 %);
-
терапевтический ответ на ГКС;
-
отсутствие иных причин ХК.
Лечение эозинофильного бронхита
Как отмечают авторы работы, при лечении ЭБ в первую очередь необходимо устранение контакта с причинно-значимым фактором [8, 13]. Из лекарственных средств (ЛС) в качестве терапии 1 линии рекомендованы ингаляционные глюкокортикостероиды (ИГКС), как препараты 2 ряда — антилейкотриеновые ЛС [40, 41].
Через месяц терапии препаратами 1 линии у большинства пациентов отмечается уменьшение кашля и снижение количества эозинофилов в мокроте [42, 43]. При анализе эффективности применения ИГКС в зависимости от сроков терапии [43] было установлено, что при прекращении использования будесонида через месяц риск рецидива ЭБ на протяжении года составил 41,9 % в сравнении с 10,7 % у пациентов с длительностью лечения 4 месяца. Авторы работы представляют наглядные данные на рисунке 2:
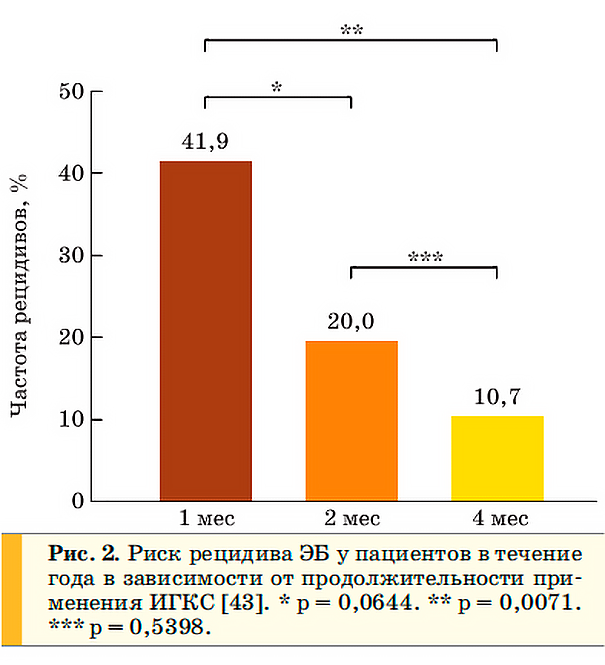
Аналогичные результаты были получены в ходе других подобных исследований [44].
Среди препаратов второй линии, по данным авторов исследования, хорошо зарекомендовал себя монтелукаст [41, 45, 46]. Так, при его добавлении к ИГКС после 2‑недельной терапии определялось более выраженное уменьшение кашля в сравнении с монотерапией. Аналогичные результаты были получены при оценки присоединения монтелукаста через 4 недели от начала лечения.
Если за основу оценки эффективности комбинированной и монотерапии брать уровень эозинофилов в мокроте, то преимуществ комбинированной терапии в ранние сроки лечения не отмечалось. Через 4 недели количество пациентов с нормальным уровнем эозинофилов в мокроте в комбинированной группе было больше, чем в группе монотерапии — 51,5 % и 25,0 % соответственно [46].
Результаты приведённых исследований говорят о высокой эффективности монотерапии ИГКС и комбинированной терапии у пациентов с ЭБ. Оптимальная длительность лечения официально не определена. При краткосрочности терапии отмечается высокий риск рецидива [43].
Уменьшение интенсивности кашля и снижение количества эозинофилов в мокроте через месяц лечения не вызывало уменьшение уровня клеток-предшественников эозинофилов в мокроте. Не было чёткой корреляции между количеством клеток-предшественников эозинофилов и эозинофилами мокроты у пациентов с эозинофильным бронхитом [47].
При персистирующем эозинофильном воспалении и кашле, устойчивом к терапии высокими дозами ИГКС, может понадобиться системная терапия ГКС [48]. Следует подчеркнуть, что у некоторых пациентов эозинофилия мокроты может оставаться в бессимптомный период [1].
Приведённые результаты говорят, что для профилактики рецидивов требуется более продолжительная терапия ЭБ (не менее 4 месяцев). Снижение интенсивности кашля и уменьшение уровня эозинофилов в мокроте при краткосрочном курсе лечения не свидетельствуют о стойкой эффективности проводимой фармакотерапии.
Эволюция эозинофильного бронхита
Как отмечают авторы работы, течение ЭБ вариабельно. Существуют риски развития обструкции дыхательных путей, включая бронхиальную астму у пациентов с рецидивирующим течением ЭБ. Так, показатели объёма форсированного выдоха на 9‑м и 12‑м месяцах исследования были существенно ниже в группе ЭБ с рецидивами, чем в группе без них [49].
Из 32 пациентов, наблюдавшихся с эозинофильным бронхитом в течение 1 года, только у 1 было отмечено полное исчезновение симптомов, у 72 % пациентов сохранялась постоянная симптоматика с воспалением НДП, у 9 % — развилась БА с характерной клиникой, у 16 % — сформировалась обструкция бронхов [48].
Предполагается, что ЭБ предшествует эозинофильному типу ХОБЛ. У 30–40 % пациентов с ХОБЛ отмечалась эозинофилия мокроты. Это объясняет наличие у части пациентов с ХОБЛ эозинофильного воспаления нижних дыхательных путей, ассоциированного с предшествующим эозинофильным бронхитом [50, 51].
Прогрессирующая необратимая обструкция НДП может развиваться из‑за их ремоделирования, вторичного по отношению к стойкому эозинофильному воспалению в бронхах на фоне неадекватной терапии ГКС [49]. В итоге авторы приходят к выводу, что ранняя диагностика и эффективное лечение ЭБ имеют решающее значение для дальнейшего прогноза заболевания.
Источники
- Yıldız T, Dülger S. Non-astmatic eosinophilic bronchitis. Turkish Thoracic Journal 2018;19(1):41-5.
- Finley CR, Chan DS, Garrison S, Korownyk C, Kolber MR, Campbell S, Eurich DT, Lindblad AJ, Vandermeer B, Allan GM. What are the most common conditions in primary care? Systematic review. Canadian Family Physician 2018;64(11):832-40.
- Irwin RS, Baumann MH, Bolser DC, Boulet LP, Braman SS, Brightling CE, Brown KK, Canning BJ, Chang AB, Dicpinigaitis PV, Eccles R, Glomb WB, Goldstein LB, Graham LM, Hargreave FE, Kvale PA, Lewis SZ, McCool FD, McCrory DC, Prakash UBS, Pratter MR, Rosen MJ, Schulman E, Shannon JJ, Hammond CS, Tarlo SM. American College of Chest Physicians (ACCP) diagnosis and management of cough executive summary: ACCP evidence-based clinical practice guidelines. Chest 2006 Jan;129(1 Suppl):1S-23S.
- Morice AH, Fontana GA, Sovijarvi AR, Pistolesi M, Chung KF, Widdicombe J, O’Connell F, Geppetti P, Gronke L, De Jongste J, Belvisi M, Dicpinigaitis P, Fischer A, McGarvey L, Fokkens WJ, Kastelik J; ERS Task Force. The diagnosis and management of chronic cough. The European Respiratory Journal 2004 Sep;24(3):481-92.
- Chung KF, Pavord ID. Prevalence, pathogenesis, and causes of chronic cough. The Lancet 2008 Apr;371(9621):1364-74.
- Pratter MR. Unexplained (idiopathic) cough: ACCP evidence-based clinical practice guidelines. Chest 2006 Jan;129(1 Suppl):220S-1S.
- Xie J, Chung KF, Lai K. Uncommon causes of chronic cough associated with airway eosinophilia. Journal of Thorac Disease 2021 May;13(5):3191-6.
- Niimi A. Narrative review: how long should patients with cough variant asthma or non-asthmatic eosinophilic bronchitis be treated? Journal of Thorac Disease 2021 May;13(5):3197-214.
- Magni C, Chellini E, Zanasi A. Cough variant asthma and atopic cough. Multidisciplinary Respiratory Medicine 2010 Apr;5(2):99-103.
- Gibson PG, Dolovich J, Denburg J, Ramsdale EH, Hargreave FE. Chronic cough: eosinophilic bronchitis without asthma. The Lancet 1989 Jan;1(8651):1346-8.
- Brightling CE, Ward R, Goh KL, Wardlaw AJ, Pavord ID. Eosinophilic bronchitis is an important cause of chronic cough. American Journal of Respiratory and Critical Care Medicine 1999 Aug;160(2):406-10.
- Cho J, Choi SM, Lee J, Park YS, Lee SM, Yoo CG, Kim YW, Han SK, Lee CH. Clinical outcome of eosinophilic airway in flammation in chronic airway diseases including nonasthmatic eosinophilic bronchitis. Scientific Reports 2018 Jan;8(1):146.
- Quirce S. Eosinophilic bronchitis in the workplace. Current Opinion in Allergy and Clinical Immunology 2004 Apr;4(2):87-91.
- Wiggans RE, Barber CM. Metalworking fluids: a new cause of occupational non-asthmatic eosinophilic bronchitis. Thorax 2017 Jun;72(6):579-80.
- Ogawa H, Fujimura M, Heki U, Kitagawa M, Matsuda T. Eosinophilic bronchitis presenting with only severe dry cough due to bucillamine. Respiratory Medicine 1995 Mar;89(3):219-21.
- Cernomaz AT, Bordeianu G, Terinte C, Gavrilescu C.M. Nonasthmatic eosinophilic bronchitis in an ulcerative colitis patient – a putative adverse reaction to mesalazine: a case report and review of literature. World Journal of Clinical Cases 2020 Sep;8(18):4162-8.
- Butler B, Rubio C, Ie S, Loschner A. Chronic cough and drug-induced eosinophilic bronchitis. Internal Medicine Journal 2022 Jan;52(1):150-1.
- Park SW, Jangm HK, An MH, Min JW, Jang AS, Lee JH, Park CS. Interleukin-13 and interleukin-5 in induced sputum of eosinophilic bronchitis: comparison with asthma. Chest 2005 Oct;128(4):1921-7.
- Gonlugur U, Gonlugur TE. Eosinophilic bronchitis without asthma. International Archives of Allergy and Immunology 2008;147(1):1-5.
- Zhan C, Xu R, Liu J, Zhang S, Luo W, Chen R, Lai K. Increased sputum IL-17A level in non-asthmatic eosinophilic bronchitis. Lung 2018 Dec;196(6):699-705.
- Zhan C, Liu J, Xu R, Liang W, Luo W, Zhong N, Lai K, Sehmi R, Chen R. Increased numbers of group 2 innate lymphoid cells in the airways of patient with eosinophilic bronchitis. Respirology 2018;23(Suppl 2):75-6.
- Huang J, Liu J, Xian Y, Liu B, Wu Y, Zhan C, Liang W, Luo W, Lai K, Chen R. Elevated circulating CD4+CD25+CD127– /low regulatory T cells in patients with non-asthmatic eosinophilic bronchitis. Lung 2020 Jun;198(3):491-7.
- Brightling CE, Symon FA, Birring SS, Bradding P, Wardlaw AJ, Pavord ID. Comparison of airway immunopathology of eosinophilic bronchitis and asthma. Thorax 2003 Jun;58(6):528-32.
- Brightling CE, Ward R, Woltmann G, Bradding P, Sheller JR, Dworski R, Pavord ID. Induced sputum inflammatory mediator concentrations in eosinophilic bronchitis and asthma. American Journal of Respiratory and Critical Care Medicine 2000 Sep;162(3 Pt 1):878-82.
- Fujimura M, Ogawa H, Yasui M, Matsuda T. Eosinophilic tracheobronchitis and airway cough hypersensitivity in chronic non-productive cough. Clinical & Experimental Allergy 2000 Jan;30(1):41-7.
- Diver S, Russell RJ, Brightling CE. Cough and eosinophilia. The Journal of Allergy and Clinical Immunology. In Practice 2019 Jul-Aug;7(6):1740-7.
- Zhang Q, Luo W, Zhan W, Xie J, Wang H, Chung KF, Lai K. Non-asthmatic eosinophilic bronchitis is characterized by proximal airway eosinophilic inflammation as compared with classic asthma and cough variant asthma. Clinical & Experimental Allergy 2021 Dec;51(12):1637-40.
- Wang JL, Ren ZY, Xia JB, Huang S, Qi MH, Wang LM, Ye J. [The mechanism of airway inflammation in eosinophilic bronchitis and cough variant asthma.] Zhonghua Jie He He Hu Xi Za Zhi 2011 Jun;34(6):433-7.
- Sastre B, del Pozo V. Role of PGE2 in asthma and nonasthmatic eosinophilic bronchitis. Mediators of Inflammation 2012;2012:645383.
- Rouadi PW, Idriss SA, Bousquet J, Laidlaw TM, Azar CR, Al-Ahmad MS, Yañez A, Al-Nesf MAY, Nsouli TM, Bahna SL, Abou-Jaoude E, Zaitoun FH, Hadi UM, Hellings PW, Scadding GK, Smith PK, Morais-Almeida M, Gómez RM, Gonzalez Diaz SN, Klimek L, Juvelekian GS, Riachy MA, Canonica GW, Peden D, Wong GWK, Sublett J, Bernstein JA, Wang L, Tanno LK, Chikhladze M, Levin M, Chang YS, Martin BL, Caraballo L, Custovic A, Ortega-Martell JA, Jensen-Jarolim E, Ebisawa M, Fiocchi A, Ansotegui IJ. WAO-ARIA consensus on chronic cough – Part II: Phenotypes and mechanisms of abnormal cough presentation – Updates in COVID-19. The World Allergy Organization Journal 2021 Nov;14(12):100618.
- Kim YH, Kim KW, Baek J, Park HB, Kim H, Song KJ, Lee JM, Sohn MH, Kim KE. Usefulness of impulse oscillometry and fractional exhaled nitric oxide in children with eosinophilic bronchitis. Pediatric Pulmonology 2013 Mar;48(3):221-8.
- Song WJ, Kim HJ, Shim JS, Won HK, Kang SY, Sohn KH, Kim BK, Jo EJ, Kim MH, Kim SH, Park HW, Kim SS, Chang YS, Morice AH, Lee BJ, Cho SH. Diagnostic accuracy of fractional exhaled nitric oxide measurement in predicting cough-variant asthma and eosinophilic bronchitis in adults with chronic cough: a systematic review and meta-analysis. Journal of Allergy and Clinical Immunology 2017;140(3):701-9.
- Alving K, Malinovschi A. Basic aspects of exhaled nitric oxide. European Respiratory Monograph 2010;49:1-31.
- Ren Y, Dai H. Eosinophilic bronchitis. The New England Journal of Medicine 2017 Aug;377(9):873.
- Brightling CE. Chronic cough due to nonasthmatic eosinophilic bronchitis: ACCP evidence-based clinical practice guidelines. Chest 2006 Jan;129(1 Suppl):116S-21S.
- Corrao WM, Braman SS, Irwin RS. Chronic cough as the sole presenting manifestation of bronchial asthma. The New England Journal of Medicine 1979 Mar;300(12):633-7.
- Lai K, Zhan W, Wu F, Zhang Y, Lin L, Li W, Yi F, Jiang Z, Dai Y, Li S, Lin J, Yuan Y, Jiang Y, Qiu C, Zhao L, Chen M, Qiu Z, Li H, Chen R, Luo W, Xie J, Guo C, Jiang M, Yang X, Shi G, Sun D, Chen R, Chung KF, Shen H, Zhong N. Clinical and inflammatory characteristics of the Chinese APAC cough variant asthma cohort. Frontiers in Medicine 2022 Jan;8:807385.
- Rybka-Fraczek A, Dabrowska M, Grabczak EM, Bialek-Gosk K, Klimowicz K, Truba O, Nejman-Gryz P, Paplinska-Goryca M, Krenke R. Inflammatory phenotypes of cough variant asthma as response predictors to anti-asthmatic therapy. Journal of Inflammation Research 2022 Jan;15:595-602.
- Park SW, Park JS, Lee YM, Lee JH, Jang AS, Kim DJ, Hwangbo Y, Uh ST, Kim YH, Park CS. Differences in radiological/HRCT findings in eosinophilic bronchitis and asthma: implication for bronchial responsiveness. Thorax 2006 Jan;61(1):41-7.
- Morice AH, Millqvist E, Bieksiene K, Birring SS, Dicpinigaitis P, Domingo Ribas C, Hilton Boon M, Kantar A, Lai K, McGarvey L, Rigau D, Satia I, Smith J, Song WJ, Tonia T, van den Berg JWK, van Manen MJG, Zacharasiewicz A. ERS guidelines on the diagnosis and treatment of chronic cough in adults and children. The European Respiratory Journal 2020;55(1):1901136.
- Côté A, Russell RJ, Boulet LP, Gibson PG, Lai K, Irwin RS, Brightling CE; CHEST Expert Cough Panel. Managing chronic cough due to asthma and NAEB in adults and adolescents: CHEST guideline and Expert Panel report. Chest 2020;158(1):68-96.
- Brightling CE, Ward R, Wardlaw AJ, Pavord ID. Airway in flammation, airway responsiveness and cough before and after inhaled budesonide in patients with eosinophilic bronchitis. The European Respiratory Journal 2000 Apr;15(4):682-6.
- Zhan W, Tang J, Chen X, Yi F, Han L, Liu B, Luo W, Chen Q, Lai K. Duration of treatment with inhaled corticosteroids in nonasthmatic eosinophilic bronchitis: a randomized open label trial. Therapeutic Advances in Respiratory Disease 2019;13:1753466619891520.
- Lai K, Liu B, Xu D, Han L, Lin L, Xi Y, Wang F, Chen R, Luo W, Chen Q, Zhong N. Will nonasthmatic eosinophilic bronchitis develop into chronic airway obstruction?: a prospective, observational study. Chest 2015 Oct;148(4):887-94.
- Cai C, He MZ, Zhong SQ, Tang Y, Sun BQ, Chen QL, Zhong NS. Add-on montelukast vs double-dose budesonide in nonasthmatic eosinophilic bronchitis: a pilot study. Respiratory Medicine 2012 Oct;106(10):1369-75.
- Bao W, Liu P, Qiu Z, Yu L, Hang J, Gao X, Zhou X. Efficacy of add-on montelukast in nonasthmatic eosinophilic bronchitis: the additive effect on airway inflammation, cough and life quality. Chinese Medical Journal 2015 Jan;128(1):39-45.
- Zhan C, Xu R, Li B, Liu J, Liang W, Zhang S, Fang L, Zhong S, de Silva SDSH, Sivapalan D, Luo W, Li J, Lai K, Zhong N, Sehmi R, O’Byrne PM, Chen R. Eosinophil progenitors in patients with non-asthmatic eosinophilic bronchitis, eosinophilic asthma, and normal controls. Frontiers in Immunology 2022 Mar;13:737968.
- Berry MA, Hargadon B, McKenna S, Shaw D, Green RH, Brightling CE, Wardlaw AJ, Pavord ID. Observational study of the natural history of eosinophilic bronchitis. Clinical & Experimental Allergy 2005 May;35(5):598-601.
- Park SW, Lee YM, Jang AS, Lee JH, Hwangbo Y, Kim DJ, Park CS. Development of chronic airway obstruction in patients with eosinophilic bronchitis: a prospective follow-up study. Chest 2004 Jun;125(6):1998-2004.
- Brightling CE, Monteiro W, Ward R, Parker D, Morgan MD, Wardlaw AJ, Pavord ID. Sputum eosinophilia and shortterm response to prednisolone in chronic obstructive pulmonary disease: a randomised controlled trial. The Lancet 2000 Oct;356(9240):1480-5.
- Pizzichini E, Pizzichini MM, Gibson P, Parameswaran K, Gleich GJ, Berman L, Dolovich J, Hargreave FE. Sputum eosinophilia predicts benefit from prednisone in smokers with chronic obstructive bronchitis. American Journal of Respiratory and Critical Care Medicine 1998 Nov;158(5 Pt 1):1511-7.





 Катрен Стиль
Катрен Стиль 1.jpg)

зарегистрированным пользователям