
Болезнь Рандю — Ослера
Ребенка пять лет безуспешно лечили от тяжелой астмы, пока не выяснили, что на самом деле причина в другой редкой патологии
11‑летний мальчик из Хорватии страдал бронхиальной астмой с шести лет. За полгода до госпитализации течение болезни значительно ухудшилось — приступы астмы стали плохо купироваться ранее назначенными препаратами. Затем пациент стал жаловаться на плохой аппетит и частые головные боли, начали нарастать одышка и цианоз. В связи с этим мальчика положили в терапевтическое отделение больницы.
Маленький пациент жаловался на одышку при нагрузке и несколько обострений астмы, одно из которых завершилось госпитализацией в предыдущем месяце. При обострениях ребенку назначали системные кортикостероиды с постепенным снижением дозировки, впрочем, без уменьшения хронической гипоксии и других симптомов. На момент поступления пациент получал:
- ингаляции адреномиметика и глюкокортикостероида (флутиказон и салметерол 250 мкг / 50 мкг два раза в день);
- бронхолитик монтелукаст — 5 мг один раз в день;
- ингаляции адреномиметика сальбутамола по мере необходимости (на момент поступления — четыре раза в день).
С детства мальчик страдал атопическим дерматитом, в грудном возрасте была аллергия на коровье молоко, с трех лет беспокоили носовые кровотечения. В шесть лет ребенку диагностировали бронхиальную астму из‑за повторяющихся эпизодов хрипов и положительного бронхопровокационного теста с физической нагрузкой. Кожная аллергопроба показала чувствительность к домашнему пылевому клещу и травяной пыльце. После того как пациенту поставили диагноз «астма», его регулярно наблюдал детский пульмонолог. Последние два года заболевание протекало бессимптомно — без профилактики и назначения сильнодействующих препаратов.
Когда мальчика привезли в больницу, его общее состояние характеризовалось как «средней степени тяжести»: одышка, кожа и видимые слизистые оболочки — бледные, до синюшности, гипоксия в состоянии покоя (уровень кислорода в крови (SaO2) 92 % при норме ≥ 95 %). Кроме того, над левым легким выслушивались прерывистые шумы, справа везикулярное дыхание было ослаблено. При осмотре врачи обнаружили две телеангиэктазии на левой щеке и дискретные телеангиэктазии на спине. При ультразвуковом исследовании сердца патологии не выявлено, легочной гипертензии нет.
Спирометрия (специальное исследование функции дыхательной системы) показала жизненную ёмкость лёгких (ЖЕЛ) 2,65 л (79 % от нормального показателя), объем форсированного выдоха в 1 секунду (ОФВ1) 2,61 л (97 % нормы), соотношение ОФВ1/ЖЕЛ = 95 % (норма). После ингаляции бронхолитика ОФВ1 и ЖЕЛ увеличились на 5 %. Однако при бронхиальной астме прирост в таком случае составляет более 12 %.
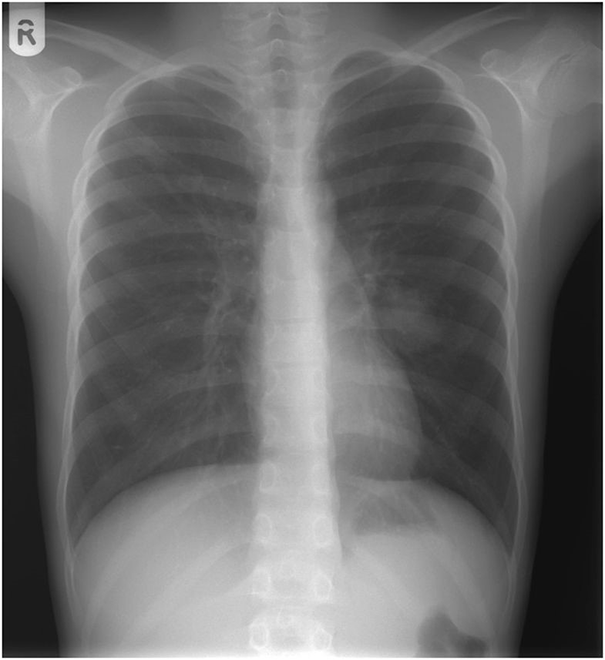
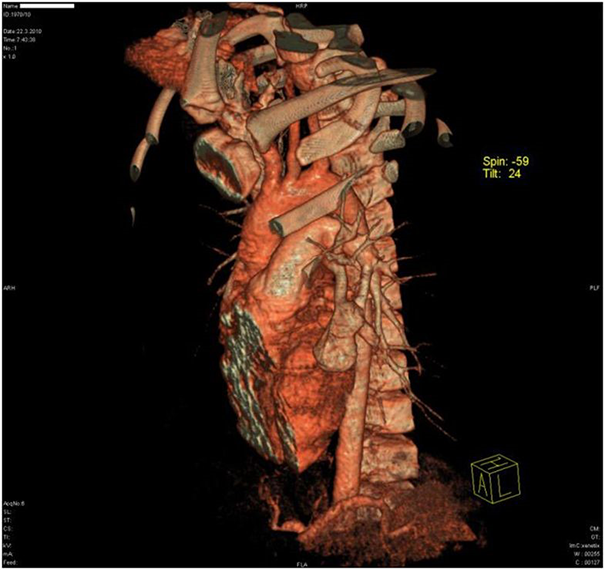
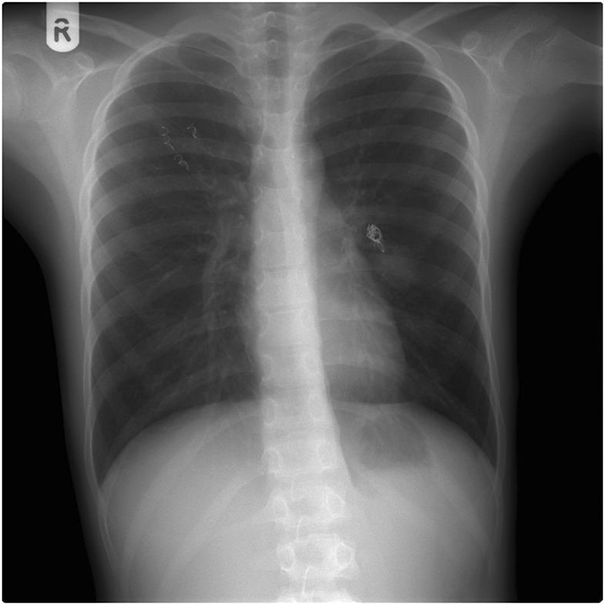
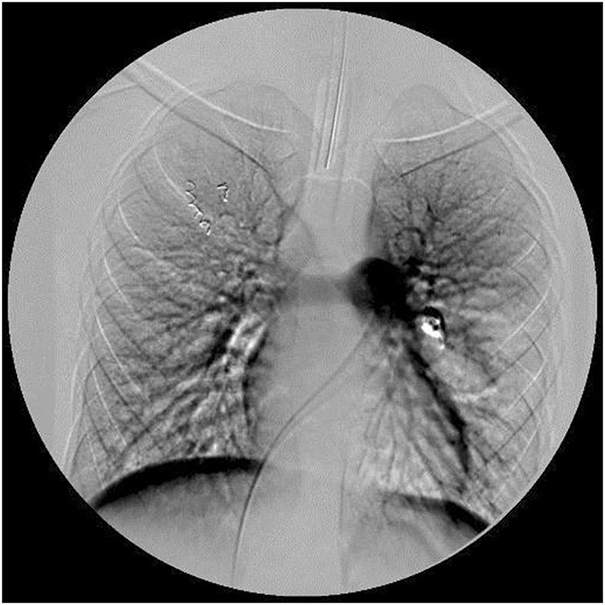
Нехарактерные для астмы показатели спирометрии заставили врачей усилить диагностический поиск. Мальчику назначили бронхоскопию. Она показала сдавление левого бронха в язычковом сегменте легкого, а на рентгенограмме в области этого бронха была видна однородная масса мягких тканей размером 20 × 30 мм (рис. 1). Нельзя было исключить опухолевый рост. К счастью, при компьютерной томографии (КТ) выявлена не опухоль, 35‑миллиметровая артериовенозная мальформация (АВМ) в области сдавленного бронха и небольшая АВМ в верхушке правого легкого (рис. 2). АВМ слева имела одну питающую артерию и большую аневризму. Правая АВМ получала питание из двух артерий (рис. 3, 4).
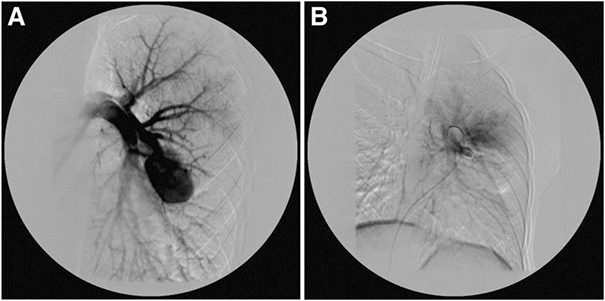
A. Артериовенозная мальформация и аневризма сегментарной ветви легочной артерии.
B. Состояние после эмболизации сегментарной левой ветви легочной артерии с окклюзией артериовенозной аномалии.
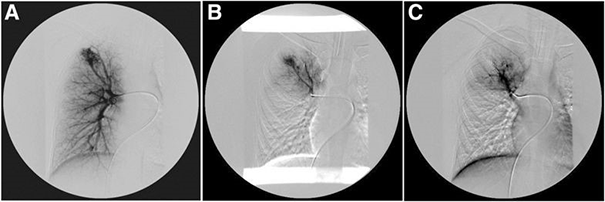
A. Артериовенозная мальформация верхушки правого легкого с двумя питающими артериями.
B. Состояние после эмболии одной из артерий АВМ. C. Состояние после эмболии второй артерии АВМ.
Во время госпитализации мальчику провели генетический анализ, в результате обнаружилась мутация в гене трансмембранного белка эндоглина, что типично для синдрома Рандю — Ослера.
Для лечения этого случая болезни Рандю—Ослера врачи приняли решение эмболизировать (избирательно закупорить, — прим. ред.) мальформации в легких с помощью спиралей из нержавеющей стали (рис. 5). Спирали вводили с помощью катетера через бедренную артерию. Диаметр спиралей был равен или на 10 % превышал диаметр артерий, питающих мальформации (рис. 3, 4). После операции ток крови через АВМ прекратился (рис. 6). Пульсоксиметрия показала увеличение кислородной сатурации периферической крови с 92 % до 97 % непосредственно на воздухе.
Исчезла болезненная бледность, мальчик стал лучше переносить нагрузки. Симптомы удушья и дыхательной недостаточности не проявлялись в течение всего периода наблюдения (шесть месяцев после процедуры). Кроме того, врачи с помощью МРТ головного мозга и шейного отдела позвоночника убедились в отсутствии угрожающих жизни пациента церебро-спинальных АВМ. Углубленный сбор анамнеза выявил положительную семейную историю болезни Рандю — Ослера: у двоюродного брата отца пациента была диагностирована АВМ в головном мозге.
Как не спутать астму с другой патологией
Этот случай интересен тем, что пациенту первоначально неправильно диагностировали бронхиальную астму и пять лет лечили от заболевания, которого не было. Диагноз не вызывал сомнений, поскольку у мальчика имели место аллергическая предрасположенность, частая одышка, низкая переносимость физических нагрузок и несколько типичных астматических приступов. При КТ-ангиографии выявлено две АВМ — по одной в правом и левом легком. Клинический диагноз — болезнь Рандю — Ослера — врачи поставили на основании трех критериев Кюрасао (носовое кровотечение, слизистые телеангиэктазии и легочные АВМ), а затем подтвердили генетически.
Астма — распространенное заболевание, однако многие болезни имеют схожие симптомы. Это следует учитывать особенно в тех случаях, когда симптомы астмы плохо поддаются терапии [4]. Согласно решению конгресса Американского торакального общества, для определения рефрактерной или тяжелой астмы используются большие и малые критерии. Большие критерии:
- а) непрерывное или почти непрерывное (> 50 % года) лечение пероральными кортикостероидами;
- b) необходимость лечения высокодозными ингаляционными кортикостероидами.
Малые критерии:
- а) одно или несколько обострений астмы в год;
- b) ежедневное использование β2‑агониста короткого действия из‑за симптомов астмы;
- c) обструкция дыхательных путей (ОФВ1<80 % предсказанной);
- d) пациент нуждается в трех или более пероральных курсах кортикостероидов в год;
- e) тяжелейшие приступы удушья, с вероятным летальным исходом;
- f) ухудшение состояния в связи с уменьшением дозы стероидов;
- g) требуется ежедневный прием дополнительных средств, например, β2‑агониста длительного действия, антагониста лейкотриеновых рецепторов или теофиллина [5].
Для диагностики трудно контролируемой астмы необходимо наличие двух больших критериев или одного большого и двух малых [3]. Трудно контролируемая астма может быть разделена на две подгруппы: во‑первых, настоящая трудно контролируемая астма, требующая тщательной диагностики и наблюдения пульмонолога; и во‑вторых, ложная трудно контролируемая астма. Четыре различные группы состояний могут быть причиной ложной трудно контролируемой астмы. Во-первых, неправильный диагноз астмы, за которым могли скрываться врожденные аномалии верхних дыхательных путей, обструкция дыхательных путей, гастроэзофагеальный рефлюкс, кистозный фиброз, бронхоэктатическая болезнь, сердечная патология и др. Во-вторых, астма с сопутствующими заболеваниями. В-третьих, постоянное воздействие отягчающих факторов. В-четвертых, несоблюдение схемы лечения, неправильный выбор ингаляторов или неверная техника ингаляции [3].
Классификация, опасность и лечение легочных АВМ
Легочные АВМ — редкая патология. На 15 000 последовательных вскрытий обнаружено только три случая легочных АВМ [6]. Клиника Майо (Рочестер, Миннесота, США, одна из крупнейших клиник в мире, в ней работает около 3800 врачей и ученых) сообщила о 194 случаях легочных АВМ в течение 45 лет — 4,3 случая в год [7, 8, 9]. Легочная АВМ может быть приобретенной или врожденной, и приблизительно 70 % случаев мальформаций связаны с болезнью Рандю — Ослера [10]. Легочные АВМ в два раза чаще встречаются у женщин, чем у мужчин [11].
Легочные АВМ могут быть простыми или сложными. Простой тип (80 % случаев) состоит из одной питающей артерии и одной отводящей вены, а сложный тип (20 % случаев) имеет две или более питающие артерии или отводящие вены [12, 13]. Более половины легочных АВМ находятся в нижних отделах, реже всего мальформации встречаются в верхних отделах [12, 14]. У пациентов с болезнью Рандю — Ослера легочные мальформации — множественные (35–65 %) [8, 15, 16] и обычно связаны с тяжелыми осложнениями и инфекциями [17]. У 25 % пациентов с синдромом Рандю — Ослера обнаружены двусторонние легочные АВМ [18].
У большинства пациентов с легочными АВМ имеется симптоматика, которая часто развивается между четвертым и шестым десятилетиями жизни, когда из артериальной системы в венозную через мальформации шунтируется более 25 % от общего объема циркулирующей крови [6, 19, 20]. Напомним, что в малом кругу кровообращения по артериям течет венозная кровь, а по венам — артериальная. Одышка при нагрузке является наиболее распространенной жалобой у пациентов с легочными АВМ, она наблюдается примерно у половины пациентов [15, 23, 24]. Другие симптомы: кровохарканье (примерно у 10 % пациентов), боль в груди (6 %), пальцы в форме барабанных палочек (20 %), цианоз (18 %) и торакальные шумы (3 %) [15]. Симптомы болезни Рандю — Ослера обычно становятся заметными до 20 лет (например, носовое кровотечение, телеангиоэктазии на коже) [21, 22]. У нашего пациента была одышка при нагрузке с хронической гипоксией, и он был устойчив к традиционной терапии астмы. Торакальный шум был обнаружен при физикальном осмотре.
Классический рентгенографический вид легочной АВМ — круглая или овальная масса однородной плотности, резко выраженная, чаще в нижних долях, диаметром от одного до пяти сантиметров. Чувствительность рентгенограммы грудной клетки составляет 70 % при диагностике АВМ [10]. У описанного пациента рентгенограмма грудной клетки показала однородную массу мягких тканей, которая могла оказаться опухолью. КТ-ангиография считается «золотым стандартом» для диагностики легочных АВМ с чувствительностью более 97 % [27].
Наличие легочных мальформаций чревато опасными для жизни осложнениями: инсульт, абсцесс головного мозга, гемоторакс и кровохарканье, особенно у женщин [28, 29]. Разрыв легочной мальформации может произойти в любом возрасте, независимо от размера поражения [30, 31, 32]. Без соответствующего лечения смертность болезни Рандю-Ослера с АВМ превышает 11 % [33].
Если все легочные мальформации размером более двух сантиметров, или если питающие артерии больше двух миллиметров в диаметре, следует лечить хирургически или с помощью эмболотерапии [8, 34].
По материалам: https://jmedicalcasereports.biomedcentral.com/articles/10.1186/1752-1947-7-32
28 сентября 2018
Текст: Автор перевода: Игнат Бородихин
Фото: depositphotos.com
Выпуск: №176, сентябрь 201826683 просмотров
26683 просмотров
Поделиться ссылкой с друзьями ВКонтакте Одноклассники
Нашли ошибку? Выделите текст и нажмите Ctrl+Enter.

 Катрен Стиль
Катрен Стиль


зарегистрированным пользователям