Биосимиляры: новая группа лекарственных средств и проблема идентичности
Роза Ягудина о том, почему так называемые аналоги биотехнологических препаратов нельзя считать дженериками
В ближайшие несколько лет истекает срок патентной защиты сразу для множества биотехнологических препаратов, которые используются в лечении сложнейших онкологических, эндокринологических и других заболеваний. Так, до 2015 года истекает срок патентной защиты у более чем 30 оригинальных биотехнологических лекарственных средств, объем мирового рынка которых составляет около 50 миллиардов долларов США. После окончания патентной защиты на рынке в большом количестве появляются аналоги биотехнологических препаратов. Уже сегодня в медицинской практике используется большое количество аналогов препаратов, которые лишились патентной защиты, например, аналогов интерферона. Однако исследования ученых показывают, что в случае с биотехнологическими препаратами говорить об «аналогах» можно только условно. На самом деле произвести препарат, на 100% идентичный биотехнологическому оригинальному препарату, очень сложно, а зачастую и невозможно. Являются ли в такой ситуации так называемые аналоги оригинальных биотехнологических препаратов (биосимиляры) безопасными для пациентов? Можно ли проводить синонимическую замену оригинального биотехнологического препарата на его аналог без риска для больного? Этим и другим вопросам, связанным с аналогами биотехнологических препаратов, посвящена наша статья.
Революция в медицине: биотехнологические лекарства - биосимиляры
Сегодня зарегистрировано более 200 биотехнологических лекарственных средств, тысячи новых препаратов изучаются в клинических исследованиях и около 300 из них находятся на завершающих стадиях исследований. Около половины всех разрабатываемых в мире препаратов — это биотехнологические лекарственные средства.
Биотехнологические препараты перевернули представления человечества о возможностях медицины, поскольку они открыли пути лечения заболеваний, еще недавно считавшихся полностью неизлечимыми. Пациенты с такими страшными диагнозами, как онкологические заболевания, диабет, рассеянный склероз, хроническая болезнь почек в стадии почечной недостаточности и другие, получили возможность полностью излечиться или существенно повысить качество жизни и увеличить ее продолжительность.
Первые поколения биотехнологических препаратов представляли собой продукты животного или растительного происхождения, например, бычий инсулин, стрептокиназа и другие. Затем появились продукты человеческого происхождения — гормон роста, антигемофильный фактор VIII. Первым биотехнологическим лекарственным средством стал рекомбинантный человеческий инсулин, выпущенным на фармацевтический рынок в 1982 году.
Сегодня под биотехнологическими лекарственными средствами в зарубежной практике (например, согласно документам Европейского медицинского агентства, EMA – European Medicines Agency) подразумеваются иммунобиологические лекарственные средства, произведенные с помощью генной инженерии. В частности, при их производстве применяется технология рекомбинантной ДНК, метод контролируемой экспрессии генов и другие. Подавляющее большинство применяемых сегодня биотехнологических препаратов представляют собой рекомбинантные белки, полученные методом генной инженерии.
В российском законодательстве отсутствует определение биотехнологического лекарственного средства. Однако дано определение иммунобиологических лекарственных препаратов, под которыми подразумеваются лекарственные препараты биологического происхождения, предназначенные для иммунологической диагностики, профилактики и лечения заболеваний.
Что такое биосимиляры?
Прежде чем дать определение этому новому термину, необходимо разобраться с тем, почему вообще возникла необходимость в нем, ведь для обозначения аналога оригинального лекарственного средства уже используется термин «дженерик», а в российском законодательстве — термин «воспроизведенное лекарственное средство».
Согласно российскому законодательству, воспроизведенное лекарственное средство — это лекарственное средство, содержащее такую же фармацевтическую субстанцию или комбинацию таких же фармацевтических субстанций в такой же лекарственной форме, что и оригинальное лекарственное средство, и поступившее в обращение после поступления в обращение оригинального лекарственного средства (ФЗ № 61 от 12 апреля 2010 г. «Об обращении лекарственных средств»). При этом в российском законодательстве под оригинальным лекарственным средством подразумевается лекарственное средство, содержащее впервые полученную фармацевтическую субстанцию или новую комбинацию фармацевтических субстанций, эффективность и безопасность которых подтверждены результатами доклинических исследований лекарственных средств и клинических исследований лекарственных препаратов (ФЗ № 61 от 12 апреля 2010 г. «Об обращении лекарственных средств»).
В зарубежной практике, в частности в Евросоюзе и США, считается, что дженерик как препарат, химически идентичный оригинальному, может быть произведен только для химических препаратов. А для биотехнологических препаратов произвести из живых организмов полностью идентичный аналог затруднительно. Можно произвести только похожий препарат — биосимиляр. Или, в другой терминологии, — биоаналог, биоаналогичный препарат, биоподобный препарат, follow-on protein products («препарат, подобный белковым лекарственным средствам»).
Определение биосимиляра дается в директиве Евросоюза 2003 года. Согласно ей, биосимиляр — это биотехнологическое лекарственное средство, схожее с произведенным впервые оригинальным лекарственным средством и представленное на регистрацию после истечения срока действия патента оригинального препарата.
В российском законодательстве понятие биосимиляра отсутствует, и подобные препараты регистрируются, согласно процедуре, аналогичной процедуре регистрации дженериков (воспроизведенных лекарственных средств). Однако за рубежом процесс регистрации биосимиляров в корне отличается от регистрации дженериков. Например, в Европе, чтобы вывести на рынок биосимиляр, необходимо провести клинические испытания, которые по объему и тщательности сопоставимы с испытаниями оригинального препарата.
Биосимиляры и дженерики: в чем разница?
Почему зарубежные ученые пришли к выводу о том, что биосимиляры нельзя считать дженериками? Ключевое различие между ними кроется в их химической структуре.
Дженерики, которые являются аналогами синтетических препаратов, имеют сравнительно простую структуру молекулы действующего вещества. С помощью методов современного химического анализа идентичность молекулы дженерика молекуле оригинального препарата может быть проверена на 100%. Именно поэтому для регистрации аналогов химических препаратов достаточно доказать идентичность действующего вещества и провести фармакокинетические исследования.
Биотехнологические препараты, напротив, имеют очень сложную структуру молекулы действующего вещества. Чаще всего это протеин, который имеет молекулярную массу в сотни и даже тысячи раз большую, чем вещества, получаемые методом химического синтеза. Причем на сегодняшний день практически не существует таких аналитических методик, которые позволяли бы оценить все биологические и клинические свойства белков в биосимилярах и на 100% подтвердить их идентичность веществам, которые использованы в оригинальных препаратах. Молекулы действующего вещества в биотехнологических препаратах имеют сложную пространственную структуру — первичную, вторичную, третичную и даже четвертичную. В одну молекулу может входить до 1300 аминокислот, а также дополнительные молекулы, например, сахара. Полностью оценить различия эффективности и безопасности между оригинальными биотехнологическими препаратами и биосимилярами можно только в ходе клинических испытаний.
Сравнение молекулы синтетического и биотехнологических препаратов
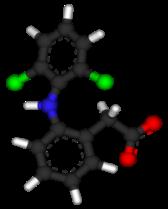
| Диклофенак |
| синтетические молекулы |
| вес молекулы = 318 Дальтон 0 аминокислот |

| Кальцитонин |
| простые биопрепараты |
| вес молекулы = 3455 Дальтон ~ 32 аминокислоты - без модификации клетки-хозяина - производится в дрожжах, бактериях
|
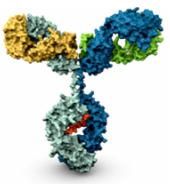
| Моноклональные антитела (IgG) |
| сложные биопрепараты |
| вес молекулы = 150 000 Дальтон ~ 1300 аминокислот - с модификацией клетки-хозяина (гликозилирование и т.д.) - производится в клетках млекопитающих
|
| Характеристики молекулы | Химический препарат | Биотехнологический препарат |
| Размер молекулы | 300–1000 Да | До 150 000 Да |
| Сложность | Простая молекула, нет аминокислот | Первичная, вторичная, третичная, четвертичная структура: более тысячи аминокислот в первичной структуре полипептидной цепи + дополнительные молекулы (например, сахара), сложная пространственная конфигурация |
| Стабильность | Обычно стабильный | Часто нестабильный, стабильность зависит от множества условий |
| Модификации | Определенная молекула | Много вариантов, различающихся по свойствам, эффективности и безопасности |
| Производство | Предсказуемый химический синтез | Сложный процесс |
| Контроль качества | Менее 500 тестов | Более 2000 тестов |
| Характеризация продукта | Легко выполнима | Очень сложна, так как это смесь близкородственных молекул |
| Создание идентичного препарата | Возможно | Затруднительно в связи со сложностью строения молекулы и сложностью процесса производства |
Не все биосимиляры одинаковы
Производство биотехнологического лекарственного средства — очень сложный процесс, который длится обычно более 10 лет. В создании нового биотехнологического препарата участвуют сотни специалистов, а стоимость его производства достигает миллиарда долларов.
Процесс производства биотехнологического препарата очень сложен. Для создания белка, который будет использован в качестве действующего вещества в биотехнологическом препарате, используется уникальная линия живых клеток. Процесс производства включает более 5000 критических этапов, а для контроля качества препарата используется более 2000 тестов. При производстве биосимиляра точно воспроизвести всю сложнейшую технологию производства действующего вещества, мягко говоря, очень сложно.
Процесс производства уникален, и отличия на каждом этапе могут влиять на эффективность и безопасность препарата. В каждом производственном процессе используют свою оригинальную комбинацию растворителей, ферментов, материалов для колонок, буферных растворов. В результате в полученном действующем веществе остаются индивидуальные «отпечатки» примесей. Практически невозможно создать два абсолютно идентичных банка клеток для производства препарата. Также на качество конечного продукта может повлиять любое изменение условий культивирования клеток, методы очистки вещества и другие этапы производства. В итоге на выходе биосимиляр должен быть очень сходным с оригинальным препаратом.
Именно в связи с этими специфическими свойствами биотехнологических лекарственных препаратов в Евросоюзе на сегодняшний день детально проработано законодательство, регламентирующее допуск в сферу медицинского применения биотехнологических препаратов и их воспроизведенных копий — биосимиляров. Не все биосимиляры, которые предоставляются для регистрации в Евросоюзе, проходят этапы экспертизы до конца. Например, EMA в 2007 году отказало в регистрации трем биоаналогам инсулина, произведенным компанией Marvel, также было отказано в регистрации препарата «Интерферон альфа» компании Bio Partners.
К чему может привести изменения структуры действующего вещества в биотехнологических препаратах? Последствия могут быть очень серьезными — от снижения эффективности препарата до возникновения аллергических реакций. Например, в 2008 году было опубликовано исследование рекомбинантных эритропоэтинов, которое выявило, что некоторые биосимиляры этого препарата имели другую фармакокинетику, скорость выведения из организма, биологическую и терапевтическую активность и иммуногенность (Хасабов Н. Н. «Биологические лекарственные средства и их биоаналоги: определение, вопросы качества, идентичности и безопасности. «Вестник Росздравнадзора» №6, 2008 г.).
Европейское медицинское агентство (EMA) разработало жесткие требования к регистрации биосимиляров. В Евросоюзе для получения регистрации биосимиляра необходимо провести практически такой же объем исследований, как и для оригинального препарата. Производитель должен доказать, что эффективность, профиль безопасности и уровень иммуногенности препарата сравнимы с соответствующим оригинальным препаратом. Для этого необходимо провести доклинические исследования, клинические исследования, исследования иммуногенности и др. EMA разработало специальные требования для регистрации препаратов даже по отдельным группам биосимиляров: соматостатины, эритропоэтины, инсулины, гепарины, интерфероны и др. В целях однозначной идентификации жесткие требования применяются и к присвоению названий биосимиляров. Кроме того, эксперты в ЕС считают, что замена оригинального препарата на биосимиляр должна быть обоснована, она не может проводиться автоматически как синонимическая замена. Окончательное решение о применении биосимиляра принимает врач под свою ответственность.
Специальные процедуры экспертизы и допуска биосимиляров в сферу медицинского применения разработаны и в других странах, например в Австралии, Малайзии, Турции, Японии, Израиле, Канаде, Южной Корее и др.
Биосимиляры в России
Несмотря на то что в российском законодательстве нет понятия «биоаналог» или «биосимиляр», существование проблемы идентичности биосимиляров оригинальным препаратам косвенно признается. Всё чаще эта проблема обсуждается на конференциях для специалистов здравоохранения. Кроме того, есть отдельные примеры, показывающие, что российские специалисты признают особую природу биотехнологических лекарственных средств. Например, еще в 2007 году на законодательном уровне было принято решение о том, что ряд лекарственных средств, в том числе и некоторые биотехнологические препараты, составляют исключение из общего правила при размещении государственных заказов и могут закупаться не по международным непатентованным, а по торговым наименованиям. Кроме того, рассматривается вопрос о составлении перечня взаимозаменяемых лекарственных средств, который, конечно же, будет иметь большое значение для рассматриваемой нами группы биотехнологических препаратов.
В настоящее время подготовлено предложение по внесению в Федеральный закон «Об обращении лекарственных средств» понятия «биоаналогичного» или «биоподобного» препарата. Термин пока что уточняется. Вероятно, можно ожидать, что, как и во многих других странах, в России будут введены специальные требования для регистрации биосимиляров.
Биотехнологические препараты — это уникальные препараты, которые существенно расширили возможности современной медицины. Сегодня, когда истекает срок действия ряда патентов оригинальных биотехнологических препаратов, неизбежно появятся биоаналоги, биосимиляры. Это позволит увеличить доступность биотехнологических препаратов для населения. Однако важно, чтобы эти сложные современные препараты проходили тщательные испытания, чтобы доказывалась их эффективность и безопасность, прежде чем они будут применены для лечения пациентов. Только в этом случае применение различных биотехнологических лекарственных средств, в том числе и биосимиляров, приведет не к снижению, а к повышению качества жизни пациентов и продлению их жизни.
Уважаемые коллеги, мы только кратко и очень обзорно коснулись такой интересной и сложной темы, как биотехнологические лекарственные средства и биосимиляры. Безусловно, в рамках одной статьи невозможно дать полную картину. Однако, если вам эта тема показалась интересной и полезной, более подробно вы можете ознакомиться с ней, прочитав подготовленную нами специальную монографию «Биотехнологические лекарственные средства и биосимиляры», которая вышла в середине прошлого года*.
*Р.И. Ягудина, М.В. Проценко «Биотехнологические лекарственные средства и биосимиляры». Издательство: «Шико», 2012
| Описание | Объем продаж в ценах конечного потребления, в миллионах USD | |||
| январь-октябрь 2012* | январь-октябрь 2011 | 2011 | 2010 | |
| Биопрепараты, полученные из естественных источников (в т. ч. бакпрепараты) | 1 463 | 1 360 | 1 641 | 1 782 |
| Биопрепараты, полученные методами генной инженерии (рекомбинантные лекарственные средства) | 1 302 | 1 367 | 1 569 | 1 458 |
|
| ||||
| Описание | Объем продаж в натуральном выражении, в миллионах упаковок | |||
| январь-октябрь 2012 | январь-октябрь 2011 | 2011 | 2010 | |
| Биопрепараты, полученные из естественных источников (в т. ч. бакпрепараты) | 127 | 115 | 143 | 199 |
| Биопрепараты, полученные методами генной инженерии (рекомбинантные лекарственные средства) | 26 | 23 | 29 | 35 |
По данным Центра маркетинговых исследований «Фармэксперт».
* Данные за ноябрь-декабрь 2012 г. на момент подготовки статьи отсутствовали.
32630 просмотров
Поделиться ссылкой с друзьями ВКонтакте Одноклассники
Нашли ошибку? Выделите текст и нажмите Ctrl+Enter.

 Катрен Стиль
Катрен Стиль

зарегистрированным пользователям