Фторхинолоны в пульмонологии: подробный обзор
Как правильно использовать хинолоны при разных патологиях дыхательной системы, и насколько патогены устойчивы к ним
Фторхинолоны относятся к одним из наиболее популярных антибактериальных средств, применяемых в пульмонологии. Поэтому по всему миру специалисты здравоохранения активно систематизируют и анализируют данные о клинических результатах этих препаратов. Так, российские исследователи Н. Б. Лазарева, Е. В. Реброва, А. Ю. Рязанова и Д. Д. Савинцева опубликовали работу «Фторхинолоны: вопросы эффективности и безопасности применения в пульмонологической практике», подробно описывающую современное состояние клинической практики хинолоновых ЛС в рассматриваемой группе нозологий. Мы публикуем её краткий обзор с указанием всех цитируемых источников и использованием авторских таблиц. Уверены, что эта статья станет хорошим справочным материалом, который пригодится нашим читателям в работе.
Классификация, спектр действия
По данным авторов исследования, на сегодняшний день создано 4 поколения хинолонов, три из которых являются фторированными хинолонами (фторхинолонами, ФХ) (табл. 1).

Хинолоны I поколения утратили практическое значения из‑за узкого спектра действия. ФХ II поколения имеют широкий спектр активности, распространяющийся в основном на грамотрицательные бактерии. ФХ III поколения активны также в отношении грамположительных бактерий, в том числе расположенных внутриклеточно [1, 2]. ФХ IV поколения, помимо этого, действуют ещё и на анаэробы.
Из-за рисков нарушения роста хрящей применение фторхинолонов запрещено у пациентов младше 18 лет [1, 2].
С практической точки зрения среди ФХ выделяют группу «респираторных» или антипневмококковых ЛС, имеющих высокую активность в отношении ДНК-гиразы грамположительных бактерий и высокую антибактериальную активность в отношении этих микроорганизмов, включая пневмококки. На отечественном фармакологическом рынке к ним относятся левофлоксацин, моксифлоксацин и гатифлоксацин [1, 2].
Механизм антимикробного действия фторхинолонов и формирования устойчивости к ним
Как отмечают авторы исследования, все хинолоны имеют общий механизм действия. Точкой их приложения являются ферменты (топоизомераза IV и ДНК-гираза), отвечающие за трансформацию молекулы бактериальной ДНК на разных этапах её репликации.
Устойчивость к этой группе препаратов развивается при снижении их сродства к комплексу «ДНК-фермент». Это становится возможным при мутации бактериальных генов (3).
При изучении резистентности пневмококков к ФХ было выяснено, что все «респираторные» ФХ имеют высокую активность в отношении штаммов Streptococcus pneumoniae (табл. 2) [6, 7].
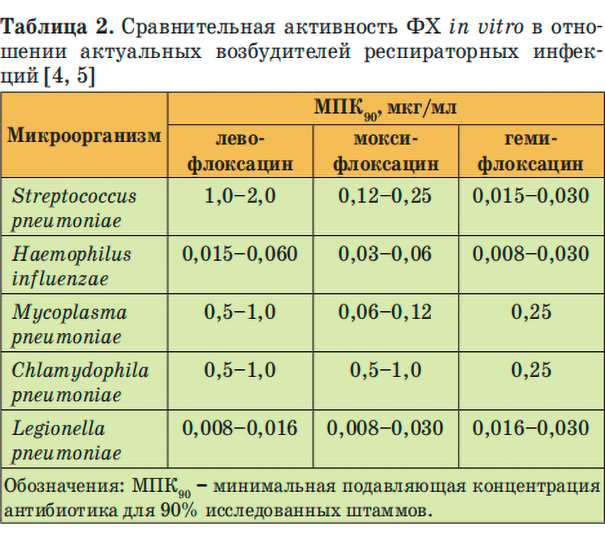
В 1999–2013 гг. все штаммы сохраняли чувствительность к левофлоксацину независимо от устойчивости к другим классам ЛС, а МПК90 (минимальная подавляющая концентрация препарата для 90 % изученных штаммов) была не более 1 мг/л.
Единственный штамм S. pneumoniae с высокой МПК90 левофлоксацина (8 мг/л) был выделен в 2000–2005 гг. При этом МПК90 моксифлоксацина и гемифлоксацина у этого штамма составили 2,0 и 0,125 мг/л соответственно, что относится к диапазону умеренной резистентности.
Из всех ФХ сравнительно низкой фармакодинамической активностью в отношении исследованных пневмококков отличался ципрофлоксацин. Диапазон устойчивости к нему составил от 16,1 % в 1999–2003 гг. до 7,8 % в 2006–2009 гг. [8].
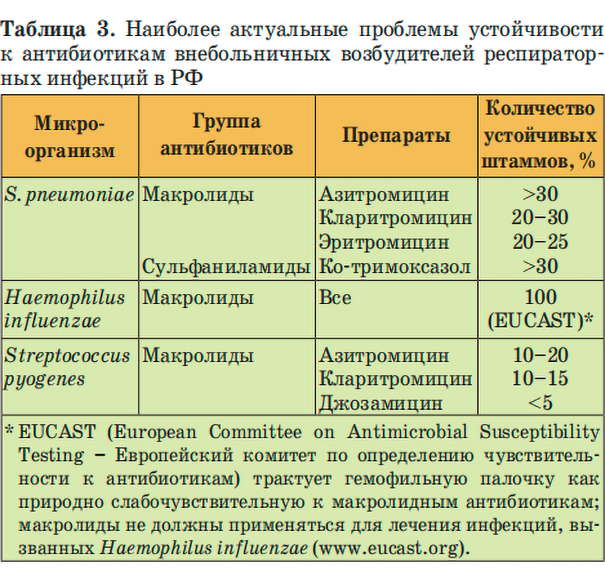
По данным авторов работы, в последние годы во всём мире, в том числе и в нашей стране, растёт частота встречаемости устойчивых к антибиотикам возбудителей внебольничных инфекций, включая пневмококк (табл. 3) [9]. Это является одним из ведущих доводов против широкого назначения ФХ при респираторных инфекциях.
Вследствие этого возникла необходимость пересмотра рекомендаций по назначению антибактериальных препаратов при амбулаторном лечении инфекций. В 2017 г. вышло два документа, регламентирующих рациональное использование антибиотиков в амбулаторной практике:
- Евразийские клинические рекомендации;
- Документ ВОЗ: 20‑й пересмотр перечня ЖНВЛП с рекомендациями по выбору антибиотиков при амбулаторных инфекциях.
В них ФХ рассматриваются как препараты резерва и не рекомендуются для амбулаторного лечения острых неосложненных инфекций органов дыхания.
Фармакокинетика и фармакодинамика фторхинолонов
Для ФХ характерны высокие показатели биодоступности, объёма распределения, проникновения в ткани, скорости абсорбции и умеренное связывание с белками плазмы. Благодаря длительному периоду полувыведения, «респираторные» ФХ назначают 1 раз в сутки (табл. 4).
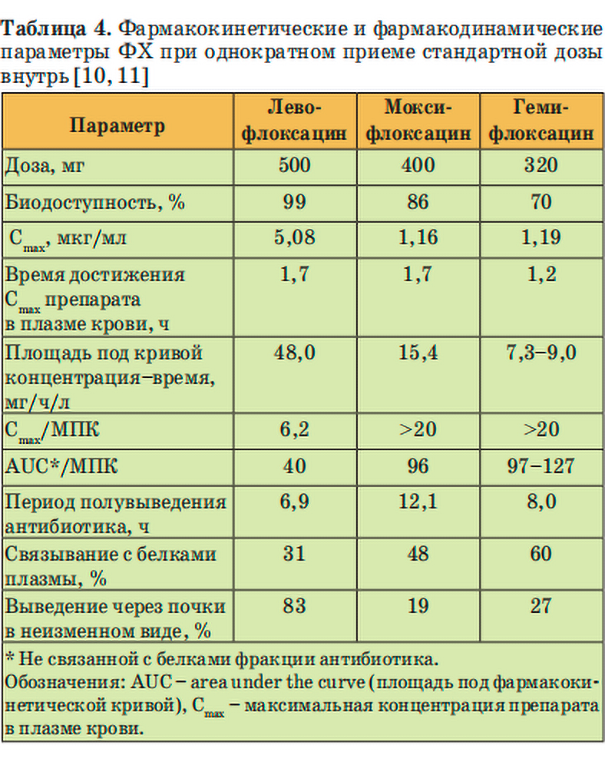
Для оценки клинической и бактериологической эффективности ФХ используют интегральный параметр AUC/МПК (AUC, area under the curve — площадь под фармакокинетической кривой).
Минимальные показатели этого параметра, при которых отмечается эффективность ФХ при лечении пневмококковых инфекций, равны 30–40. Обычные, не «респираторные» ФХ не отвечают этой характеристике.
У моксифлоксацина (400 мг однократно) этот параметр равен 200, у левофлоксацина (750 мг однократно) — 71. Для профилактики выработки устойчивости пневмококков к ФХ в ходе лечения показатели AUC/МПК должны превышать 100 [12].
«Респираторные» ФХ способны глубоко проникать в ткани, обеспечивая в макрофагах альвеол и эпителии дыхательных путей концентрации, значительно превышающие МПК чувствительных к ним возбудителей инфекций.
Устойчивость возбудителей инфекций органов дыхания к «респираторным» ФХ во всём мире остаётся низкой, исключая некоторые страны Юго-Восточной Азии [13]. В Европе >97 % штаммов S. pneumoniae чувствительны к «респираторным» ФХ [14].
По мнению авторов работы, назначение ФХ в амбулаторных условиях нужно ограничить из‑за неблагоприятного профиля безопасности и «теории параллельного ущерба»: нарушения микробиома вследствие широкого антимикробного спектра, риска антибиотикоассоциированной суперинфекции, обусловленной Clostridium difficile, риска выработки резистентности у Mycobacterium tuberculosis.
Эта точка зрения совпадает с экспертным мнением FDA (U. S. Food and Drug Administration — Управление по контролю качества пищевых продуктов и медикаментов США), рекомендующих ограничить применение ФХ в амбулаторных условиях и исключить их назначение при лечении синусита, бронхита, неосложненных инфекций мочевыводящих путей [15, 16].
Схожее мнение выразили эксперты EMA (European Medicines Agency — Европейское агентство лекарственных средств) в октябре 2018 г., посоветовав ограничить амбулаторное назначение ФХ в тех случаях, когда возможно использование других классов антибиотиков [17].
Аспекты безопасности применения фторхинолонов
История создания и дальнейшего применения ФХ наглядно иллюстрирует то, что по мере расширения спектра и усиления антибактериального действия растёт и число нежелательных явлений. Это стало причиной отзыва отдельных ЛС с фармацевтического рынка (грепафлоксацин, тровафлоксацин, клинафлоксацин и пр.) [18].
Фторхинолоны, разрешённые для использования в 80‑е гг., в наше время входят в число наиболее широко применяемых антибактериальных ЛС в амбулаторных условиях. По данным авторов работы, в США по числу выписанных рецептов фторхинолоны лидируют среди всех антибактериальных средств, а в России занимают 3‑е место, уступая пенициллинам и макролидам.
Это объясняется сочетанием благоприятных качеств ФХ, включая:
- широкий спектр действия, в том числе и в отношении внутриклеточных возбудителей;
- особенности фармакокинетики, обеспечивающие создание и поддержание высоких концентраций препаратов в очагах инфекций;
- хорошую переносимость [19].
Летом 2008 г. FDA внесло особое предупреждение об увеличении риска развития тендинита и разрыва сухожилия при приёме ФХ. Зимой 2011 г. было добавлено уточнение о повышении такого риска у людей с миастенией.
Летом 2013 г. FDA потребовало дополнить инструкцию сведениями о потенциальном риске развития необратимой периферической невропатии. Затем летом 2016 г. на сайте FDA появилась информация о риске развития нежелательных явлений (НЯ) при назначении ФХ, из‑за чего рекомендовалось не назначать их амбулаторным пациентам, если есть возможность использования альтернативных схем антибиотикотерапии [20].
Появился новый термин — «инвалидизация, ассоциированная с применением ФХ» (fluoroquinolone-associated disability, FQAD). За время с 01.11.97 по 30.05.15 гг. база данных FDA пополнилась 1122 сообщениями о вероятном развитии FQAD при использовании ФХ [21].
Под FQAD подразумевалось развитие нежелательных явлений, которые могут привести к значительному нарушению способности выполнять повседневные функции.
Критерии FQAD:
- развитие нежелательных явлений со стороны ≥2 следующих органов и систем: костно-мышечной, нейропсихической, периферической нервной системы и органов чувств, сердечно-сосудистой системы, кожи;
- обнаружение нежелательных явлений у «исходно здоровых» лиц, т. е. у тех, кто до приёма ФХ мог выполнять свои обычные функции, включая пациентов с хроническими заболеваниями в стадии компенсации;
- сохранение нежелательных явлений в течение месяца и более после отмены ФХ.
Развитие нежелательных явлений со стороны нескольких органов и систем у одного пациента с их длительным сохранением (более месяца) расценивалось как фактор, нарушающий качество жизни больше, чем инфекции, для лечения которых назначались ФХ. При этом абсолютный риск развития серьёзных нежелательных явлений при приёме фторхинолонов оказался невысоким [22].
Авторы исследования отмечают, что такие данные свидетельствуют не о слишком высоких рисках ФХ, а о больших количествах их приёма, приводящих к выявлению таких редких нежелательных явлений [23].
В связи с этим эксперты PRAC (Pharma co vigilance Risk Assessment Committee — Комитет по оценке рисков в сфере фармаконадзора) EMA рекомендовали ограничить системное применение фторхинолонов [24]. Следует отменять приём ФХ при появлении начальных признаков нежелательных явлений.
Использование фторхинолонов в пульмонологии
Как сообщают авторы работы, в обзоре PRAC EMA от 2018 г. с учётом соотношения «польза–риск» применения ФХ, было обозначено 4 категории показаний к их назначению (табл. 5) [24]:
- Вновь выявленная проблема безопасности существенно не изменяет имеющееся соотношение «польза — риск», и не требует пересмотра показаний к приёму фторхинолонов.
- Вновь выявленная проблема безопасности требует ограничения использования ФХ по этим показаниям.
- Вновь выявленная проблема безопасности меняет соотношение «польза — риск» в сторону превышения риска и требует удаления этих показаний.
- Слишком широкие или неточно сформулированные показания, требующие изменения формулировки или удаления.
Внебольничная пневмония
По данным авторов исследования, основным показанием к назначению «респираторных» фторхинолонов является внебольничная пневмония (ВП) категории 1 [24]. Длительное время основными группами ЛС в терапии ВП считались β-лактамные антибиотики и макролиды.
С открытием «респираторных» фторхинолонов появились альтернативные средства для лечения ВП при неэффективности или непереносимости терапии 1 линии. С развитием устойчивости возбудителей внебольничной пневмонии к макролидам и β-лактамным антибиотикам возросла роль резервных ЛС.
В клинических рекомендациях Минздрава РФ по ведению пациентов с внебольничной пневмонией за 2018 г. «респираторные» ФХ рассматриваются как лекарственные средства [25]:
- 1 линии — у стационарных пациентов с нетяжелым течением ВП, если есть риск резистентности; в составе комбинированной терапии в стационаре, без учёта факторов риска;
- 2 линии — у амбулаторных больных с риском резистентности; у стационарных пациентов с нетяжелой ВП без факторов риска.
Респираторные ФХ не должны назначаться амбулаторным больным без риска резистентности. Стационарным пациентам с тяжёлой ВП и факторами риска инфицирования Pseudomonas aeruginosa также возможно назначение ципрофлоксацина и левофлоксацина (табл. 6).
Острый бронхит
Чаще всего бронхит вызывается вирусами, поэтому назначения антибиотиков не требуется. Это отражено в клинических рекомендациях по лечению острого бронхита у детей Минздрава РФ от 2016 г. [26].
При этом, J. Macfarlane et al. в 1994 г. обнаружили в мокроте 45 % пациентов с острым бронхитом S. pneumoniae, Haemophilus influenzae и Moraxella catarrhalis. Однако эти бактерии могут высеваться из ротоглотки и у здоровых людей [27–30].
В соответствии с современными рекомендациями применение антибиотиков для лечения острого бронхита у взрослых без сопутствующей патологии считается нецелесообразным [31, 32]. У пожилых и ослабленных пациентов выше риск развития нежелательных явлений при приёме фторхинолонов, поэтому следует избегать назначение им этой группы препаратов [33–35].
ХОБЛ
Для обострения хронической обструктивной болезни лёгких (ХОБЛ) характерно усиление одышки, кашля, увеличение количества и изменение характера мокроты (она становится гнойной) [36]. Обычно в течение года у пациентов с ХОБЛ регистрируется 2–4 обострения [37]. Более 60 % из них вызвано вирусами или бактериями [38–40].
В метаанализе D. J. Vollenweider et al., включающем 16 рандомизированных плацебоконтролируемых исследований, были показаны достоверные преимущества антибиотикотерапии у стационарных пациентов с тяжёлым обострением [41].
У пациентов с лёгким или умеренным обострением эффект был не так заметен. У пациентов с тяжёлым обострением риск неэффективности лечения был значительно ниже в группе, получавшей антибиотикотерапию (относительный риск (ОР) 0,77; 95 % доверительный интервал (ДИ) 0,65–0,91).
Смертность была статистически значимо ниже при антибиотикотерапии у пациентов, проходивших лечение в отделении интенсивной терапии (ОИТ) (ОР 0,21; 95 % ДИ 0,06–0,72), но не у госпитализированных пациентов в общем (ОР 1,02; 95 % ДИ 0,37–2,79).
Длительность пребывания в стационаре (в днях) была одинаковой в группах антибиотикотерапии и плацебо кроме пациентов ОИТ, где применение антибиотиков способствовало статистически значимому сокращению этого показателя (средняя разница — 9,60 дня; 95 % ДИ –12,84 … — 6,36). Частота развития НЯ была больше в группе антибиотиков (ОР 1,53; 95 % ДИ 1,03–2,27).
В свою очередь, метаанализ J. A. Wedzicha et al. включал исследования по применению антибиотиков у амбулаторных пациентов с обострением ХОБЛ [36]. Было выявлено, что антибиотикотерапия уменьшает риск неэффективности терапии (27,9 против 42,2 %; ОР 0,67; 95 % ДИ 0,51–0,87) и увеличивает период ремиссии (разница медиан 73 дня; р=0,015).
Однако эффективность лечения отмечалась у большинства пациентов в группе плацебо (58 %). Использованию антибиотиков сопутствовало увеличение случаев НЯ (14,6 против 7,6 %; ОР 1,84; 95 % ДИ 0,95–3,57), хотя большая часть из них были лёгкими.
Авторы приходят к выводу, что при решении вопроса о лечении антибиотиками обострения ХОБЛ нужно взвешивать соотношение «польза — риск». Пациенты с гнойной мокротой, скорее всего, выиграют от лечения антибиотиками. Необходимо также учитывать тяжесть заболевания.
Хотя фторхинолоны достигают высоких концентраций в лёгочной ткани [42–46], риск развития резистентности к фторхинолонам и нежелательных явлений позволяет думать о том, что соотношение «польза — риск» остаётся неизменным только при тяжёлых обострениях хронического бронхита и ХОБЛ или тогда, когда другие варианты лечения неэффективны или неприемлемы.
Применение ФХ не оправданно при лёгких и среднетяжелых обострениях с возможностью альтернативных вариантов терапии. Поэтому их назначение при обострении бронхита и ХОБЛ должно ограничиваться пациентами, у которых считается нецелесообразным использовать другие антибиотики для лечения этих инфекций. В общем соотношение «польза — риск» при обострениях хронического бронхита и ХОБЛ считается положительным только у больных без альтернативных вариантов терапии [24].
В клинических рекомендациях Минздрава РФ по ведению пациентов с ХОБЛ 2018 г. сказано, что так как не всегда причиной обострения ХОБЛ являются бактерии, то необходимо уточнить показания к назначению антибиотикотерапии [47]. Это целесообразно по отношению к пациентам с обострением ХОБЛ при усилении одышки, росту объёма и повышении степени гнойности мокроты или при наличии 2 из 3 вышеназванных признаков.
Антибактериальная терапия также показана больным с тяжёлым обострением ХОБЛ, нуждающимся в ИВЛ. Предполагаемый спектр бактерий, ставших причиной обострения ХОБЛ, и выбор антибиотикотерапии зависят от тяжести течения заболевания и наличия факторов риска (табл. 7).
Инфекции нижних дыхательных путей (НДП), вызванные P. aeruginosa
По данным авторов исследования, ципрофлоксацин и левофлоксацин активны в отношении P. aeruginosa. Назначение этих фторхинолонов в составе комбинированной терапии показано в стационаре при тяжёлой внебольничной пневмонии и при нозокомиальной пневмонии (НП) с факторами риска инфекции P. aeruginosa, муковисцидозе и бронхоэктазах (табл. 8).
К факторам риска НП, вызванной микроорганизмами с множественной устойчивостью, относят предшествующую антибиотикотерапию, длительность госпитализации, перевод из другой больницы, высокий уровень антибиотикорезистентных бактерий в отделении.
Муковисцидоз
Фторхинолоны обычно применяют в терапии лёгочных инфекций у пациентов с муковисцидозом. Такие больные подвержены инфицированию патогенными бактериями типа Staphylococcus aureus и H. influenzae и оппортунистическими бактериями, включая P. aeruginosa.
Высокая биодоступность и широкий спектр антимикробной активности, включая антипсевдомонадные свойства, делают ФХ пригодными для лечения инфекций лёгких у этой категории пациентов [49].
Ранее публиковались результаты лечения острой инфекции P. aeruginosa у больных с муковисцидозом, многие из которых принимали ципрофлоксацин. Так, N. H. Valerius et al. доложили о хронизации инфекции P. aeruginosa у 14 % пациентов, лечившихся колистином и ципрофлоксацином в течение 3 недель, по сравнению с 58 % больных, получавших плацебо (p <0,05) [50].
М. М. Treggiari et al. в исследовании EPIC изучали целесообразность добавления ципрофлоксацина к лечению ингаляционным тобрамицином в режиме циклической терапии (смена схемы лечения каждые 3 мес.) и терапии, базирующейся на культуральном исследовании (назначение антибиотикотерапии при обнаружении P. aeruginosa в мокроте) [51].
Отмечалось отсутствие разницы между вышеуказанными режимами лечения и отсутствие принципиальной разницы между группами пациентов, получавшими в дополнение к терапии ингаляционным тобрамицином ципрофлоксацин или плацебо.
При хронизации инфекции P. aeruginosa у страдающих муковисцидозом эрадикация невозможна и основное лечение направлено на коррекцию нутритивного статуса, предупреждение осложнений и назначение активной терапии, включающей антибиотики, при обострении процесса.
Бронхоэктазы
Пациенты с бронхоэктазами, также как и больные с муковисцидозом, подвержены инфицированию P. aeruginosa. Фторхинолоны у них относятся к препаратам выбора.
В метаанализе, включающем исследования эффективности ФХ с β-лактамами и аминогликозидами по сравнению с полимиксинами, было установлено преимущество фторхинолонов перед β-лактамными антибиотиками (ОР 20,09; 95 % ДИ 2,83–142,59; р >0,05) [52].
Заключение
Фторхинолоны активны в отношении широкого спектра возбудителей инфекции дыхательных путей. Нежелательные явления заставляют ограничить назначение ФХ при таких заболеваниях как острый бронхит, обострение ХОБЛ, внебольничная пневмония нетяжелого течения без факторов риска инфицирования полирезистентными бактериями.
Фторхинолоны рекомендуется применять при тяжёлых обострениях ХОБЛ, тяжёлой ВП с факторами риска инфицирования полирезистентными бактериями, при лечении инфекций нижних дыхательных путей, вызванных полирезистентными грамотрицательными микроорганизмами, включая P. aeruginosa, чувствительными к ципрофлоксацину, инфекций НДП у пациентов с бронхоэктазами и муковисцидозом.
19 февраля 2024
Текст: Светлана Маляева
Фото: istockphotos.com/DjelicS
Выпуск: №242, февраль 202410500 просмотров
10500 просмотров
Поделиться ссылкой с друзьями ВКонтакте Одноклассники
Нашли ошибку? Выделите текст и нажмите Ctrl+Enter.

 Катрен Стиль
Катрен Стиль
зарегистрированным пользователям