Не жалея живота своего
Взаимодействие микробиома кишечника и пероральных сахароснижающих препаратов — обзор научных публикаций
Популяция микроорганизмов, обитающих в нашем кишечнике, составляет кишечную микробиоту [1]. Её ведущие функции: извлечение энергии из сложных пищевых волокон, поддержание нормальных свойств иммунитета, регенерация кишечного эпителия, защита от патогенных микроорганизмов и т. д. Взаимодействие между микробиотой кишечника и лекарственными средствами всегда имеет двунаправленный характер. Российские исследователи У. В. Буйваленко и Е. В. Покровская изучили и систематизировали научные данные по вопросу взаимодействия кишечной микрофлоры и пероральных сахароснижающих средств, описали изменение микробиоты под воздействием этой группы медикаментов, а также оценили возможные клинические последствия для человеческого организма. Труд авторов лёг в основу научной статьи «Взаимодействие микробиома кишечника и пероральных сахароснижающих препаратов: обзор литературы», опубликованной в журнале «Проблемы эндокринологии» за 2022 год. Мы публикуем краткий обзор этой работы — надеемся, что она поможет нашим читателям из числа фармспециалистов и врачей актуализировать свои знания по заявленной теме.
Введение
По данным авторов статьи, состав микробиоты обусловлен местом её локализации в организме [2]. На него влияет целый ряд факторов: возраст, питание, физическая активность, географическое местоположение. Видовой состав микрофлоры многообразен, микроорганизмы взаимодействуют на разных уровнях при помощи мутуалистических, комменсальных, конкурентных или других отношений [3].
Раньше изучение микробиоты проводилось при помощи метода культивирования. Таким образом можно было выделить 1 или несколько видов бактерий для изучения их свойств. Освоение методики секвенирования бактериального гена 16S рибосомальной РНК [4] дало возможность выполнить общую таксономическую оценку микрофлоры кишечника. Это обогатило наши сведения о её микробном составе.
Сейчас один из основных методов изучения микробиоценоза — полногеномное или метагеномное секвенирование (MGS). Он позволяет провести идентификацию бактерий, вирусов, простейших, грибов, проанализировать бактериальный геном.
Однако, результаты MGS во многом зависят от способа, применяемого для выделения ДНК из образцов стула. Это главная причина технической вариабельности результатов определения микробиоты [5].
Современные исследования показали связь состава микрофлоры и появления разных патологий. Выявлено также, что ЛС (например, сахароснижающие препараты) изменяют состав и функции кишечной микробиоты. В то же время микрофлора взаимодействует с веществами, поступившими в организм, то есть влияние является двунаправленным [6].
Обобщая вышеперечисленное, взаимодействие ЛС с микробиомом кишечника может стать причиной снижения их эффективности вследствие трансформации молекулы бактериями и изменения её биодоступности. В зависимости от группы сахароснижающих препаратов эти изменения могут различаться.
Бигуаниды (метформин)
Метформин — представитель класса бигуанидов, признан препаратом 1 линии в терапии сахарного диабета 2 типа (СД2).
Раньше механизм действия медикамента связывали только с его антиглюконеогенным действием на печень [7, 8]. В последнее время появились данные о том, что кишечная микрофлора — основной медиатор лечебного действия метформина (рис. 1).
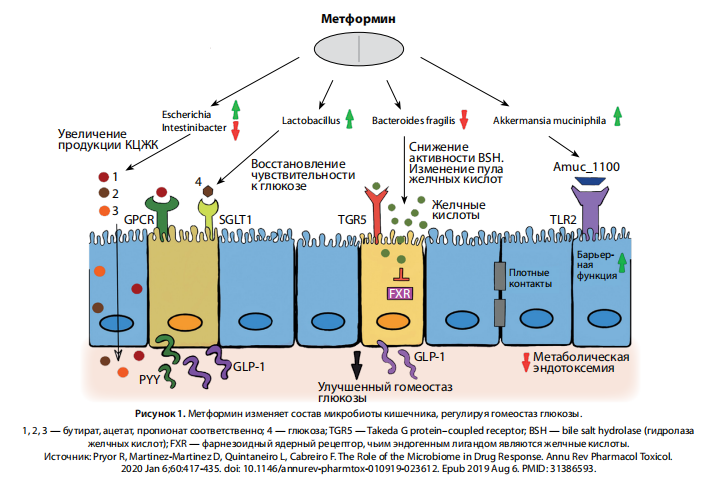
Исходя из этого внутривенный способ введения препарата для понижения концентрации глюкозы в крови считается менее эффективным, чем его приём per os [9, 10].
Обычно назначение метформина выполняется при уже подтверждённом диагнозе СД2. Это не даёт возможности провести грань между действием препарата на микробиом и изменениями, обусловленными самой болезнью.
В ряде исследований отмечалось, что у лиц с СД2 состав кишечной микробиоты изменялся в сравнении со здоровыми людьми [11]. Если быть точнее, то микрофлора кишечника людей, не получающих метформин, отличалась истощением таксонов, продуцирующих бутират, в том числе виды Roseburia, Subdoligranulum spp., Clostridiales spp. Наоборот, при приёме метформина росло число Escherichia spp. и Intestinibacter spp. [11].
В одном из исследований демонстрировалось, что ранее отмечаемые изменения в кишечном микробиоме, трактовавшиеся как следствие СД2, были вызваны приёмом метформина [11].
В другой работе подчёркивалось, что сходные изменения в микрофлоре кишечника пациентов с СД2, ранее не принимавших терапию, отмечались спустя 4 месяца от начала приёма метформина, что даёт возможность делать предположения об эффективности проведённого лечения [12].
Изменения количества бактериальных таксонов способны опосредовать лечебное воздействие метформина благодаря росту синтеза короткоцепочечных жирных кислот (КЦЖК) [11, 12], улучшающих гомеостаз и утилизацию глюкозы на моделях мышей [13].
Около 1/3 пациентов, получающих метформин, жалуются на побочные эффекты со стороны пищеварительной системы в виде диареи, метеоризма и тошноты, что может быть обусловлено факторами вирулентности и генами газового обмена (это случается из‑за роста числа видов E. coli), которые могут стать виной вышеперечисленных явлений [11].
Кроме того, метформин изменяет метаболизм бактериального фолата у Caenorhabditis elegans [14]. Это объясняет нарушение фолатного статуса [15].
Изменения микрофлоры вследствие приёма метформина способны регулировать обмен глюкозы ввиду сохранения целостности кишечного барьера из‑за роста относительной численности A. muciniphila как у грызунов [16], так и у людей [12].
Примечательно, что белок внешней мембраны, экстрагированный из A. muciniphila, активизирует толл-подобный рецептор 2‑го типа (TLR2) и воспроизводит положительное влияние интактного белка A. muciniphila на гомеостаз глюкозы и жиров у грызунов [17]. Не исключено, что трансляция сигналов TLR2 способна укреплять барьерную функцию кишечника и регулировать метаболическую эндотоксемию, вызванную СД.
Ряд исследователей предпологает, что кишечный микробиом может опосредовать эффекты метформина, действуя на продукцию гормонов кишечника. У пациентов, получающих этот препарат, определено увеличение содержания инкретинового гормона глюкагоноподобного пептида 1 (GLP-1) в плазме крови, а в ряде работ говорилось о сопутствующем увеличении концентрации пептида YY (PYY), участвующего в контроле аппетита [18].
Впервые на взаимосвязь между влиянием метформина на секрецию гормонов кишечника и микрофлорой обратили внимание при выявлении корреляции между содержанием PYY и колебаниями численности Bacteroidetes и Firmicutes spp. в образцах от пациентов с СД2, принимавших метформин [19] в виде монотерапии.
Помимо этого, есть данные, что КЦЖК могут включать продукцию GLP-1 и PYY энтероэндокринными клетками. Способы, с помощью которых это осуществимо:
- взаимодействие с рецепторами, сцепленными с G-белком;
- путём подавляющей активности гистондеацетилазы;
- воздействие на КЦЖК, как на источник получения энергии [20].
Метформин способен опосредованно активизировать выход этих гормонов, благоприятствуя увеличению видов, синтезирующих КЦЖК.
Выявлено, что экспрессия Na-глюкозного котранспортера-1 (SGLT-1), главного переносчика, отвечающего за секрецию GLP-1, активированную глюкозой, уменьшается в верхних сегментах тонкого кишечника крыс, находившихся на жирном питании [21].
Терапия метформином способствовала восстановлению экспрессии SGLT-1 и чувствительности к глюкозе, а также повышала относительную численность Lactobacillus. Примечательно, что пересадка заранее обработанной метформином микрофлоры в тонкий кишечник крыс, получающих жирную пищу, также восстанавливала экспрессию SGLT-1 и чувствительность к глюкозе.
Авторы работы отмечают, что нужны дополнительные исследования для установления механизма активации Lactobacillus — этого сенсора питательных веществ, усиливающего секрецию GLP-1 и снижающего содержание глюкозы в плазме крови.
Все вышеперечисленные наблюдения показывают, как метформин способен изменить микрофлору кишечника и как микробиом влияет на свойства этого ЛС.
Агонисты ГПП-1
В литературе есть сведения о взаимосвязи между агонистом рецепторов GLP-1 лираглутидом и модификацией состава кишечной микрофлоры [22–25]. Было продемонстрировано, что терапия лираглутидом уменьшает относительное количество ассоциированных с ожирением бактериальных филотипов в моделях СД2 и ожирения на грызунах [22–24].
В одной из работ рост числа Lactobacillus отрицательно соотносился с содержанием глюкозы в плазме крови [23]. В ответ на приём лираглутида отмечалось увеличение уровня A. muciniphila, что свидетельствует об улучшении защитной функции кишечника [25].
Некоторые ингибиторы дипептидил пептидазы-4 (DPP-4), применяемые для увеличения уровня GLP-1, тоже способны оказывать положительное влияние на организм через кишечную микробиоту.
Так, лечение вилдаглиптином приводило к уменьшению продукции Oscillibacter, увеличению продукции Lactobacillus и КЦЖК у грызунов, находящихся на западной диете [26].
Акарбоза
Акарбоза — ингибитор фермента α-глюкозидазы. Механизм его действия связан с задержкой расщепления сложных углеводов в тонком кишечнике. ЛС влияет на микробиом, способствуя увеличению определённых таксонов [27–29].
Рандомизированное исследование показало, что приём акарбозы связан с повышением числа Lactobacillus и Dialister spp., причём количество последних отрицательно соотносилось с содержанием глюкозы в крови [29].
В другой работе выявлена взаимосвязь между вызванными акарбозой изменениями кишечной микрофлоры и количеством жёлчных кислот, ассоциированных с улучшением гликемического контроля [28].
Тиазолидиндионы и ЛС сульфонилмочевины
Терапия пиоглитазоном из группы тиазолидиндионов подавляла рост численности бактерий Proteobacteria, отмечаемый у грызунов, употребляющих жирную пищу [30].
В то же время приём розиглитазона восстанавливал пространственное расположение бактерий по слизистой оболочке подвздошной кишки без восстановления их качественного состава [31].
Биодоступность гликлазида, ЛС класса сульфонилмочевины, увеличивается у крыс с диабетом после введения пробиотиков. Это подтверждает возможность взаимодействия между препаратом и микробиомом [31].
Ингибиторы SGLT-2 (глифлозины)
Один из современных классов сахароснижающих средств — глифлозины. Механизм действия основан на подавлении реабсорбции глюкозы в почках [32]. Исследователи отмечают такие положительные эффекты ингибиторов SGLT-2, как уменьшение веса, снижение концентрации триглицеридов в крови [33].
D.M. Lee и соавторы изучали влияние глифлозинов на кишечную микробиоту. Значимых изменений микробиома в сравнении с группой контроля не выявлено [34].
Обсуждения и выводы
Имеющиеся данные о взаимодействии пероральных сахароснижающих препаратах и кишечной микрофлоры недостаточны и носят противоречивый характер. Требуются продолжить научные исследования в данном направлении. Чёткая информация о механизмах взаимодействия сахароснижающих ЛС и микробиома кишечника может способствовать улучшению результатов в терапии сахарного диабета.
10 апреля 2023
Текст: Светлана Маляева
Фото: Фотобанк www.istockphoto.com/DrAfter123
Выпуск: №232, апрель 20231735 просмотров
1735 просмотров
Поделиться ссылкой с друзьями ВКонтакте Одноклассники
Нашли ошибку? Выделите текст и нажмите Ctrl+Enter.

 Катрен Стиль
Катрен Стиль 1.jpg)

зарегистрированным пользователям