Эндокринные нарушения при применении ЛС: примеры взаимодействия и подходы к изучению проблемы
Железы внутренней секреции контролируют работу всех органов и систем путём гуморального влияния. Науке известно, что при воздействии ряда эндокринных дизрапторов (ЭД) возникают гормональные нарушения [1–8]. В роли ЭД могут выступать различные химические соединения, в том числе лекарственные средства (ЛС). Этот аспект фармакотерапии привлекает внимание учёных во всём мире. Так, недавно группа российских исследователей (К. Л. Крышень, Н. М. Фаустова, М. Н. Макарова, В. Г. Макаров) опубликовала работу, в которой дана оценка возможности проведения на этапе доклинических исследований анализа рисков функциональных расстройств эндокринной системы при применении новых ЛС. Проведём краткий обзор этой публикации.
Основные механизмы действия гормональных дизрапторов
По мнению авторов исследования, на этапе разработки и доклинических исследований ЛС необходимо понимание механизмов эндокринных нарушений, связанных с действием химических веществ на организм. Эти механизмы были подробно описаны в работе M. A. La Merrill и соавт. [1], (табл. 1).
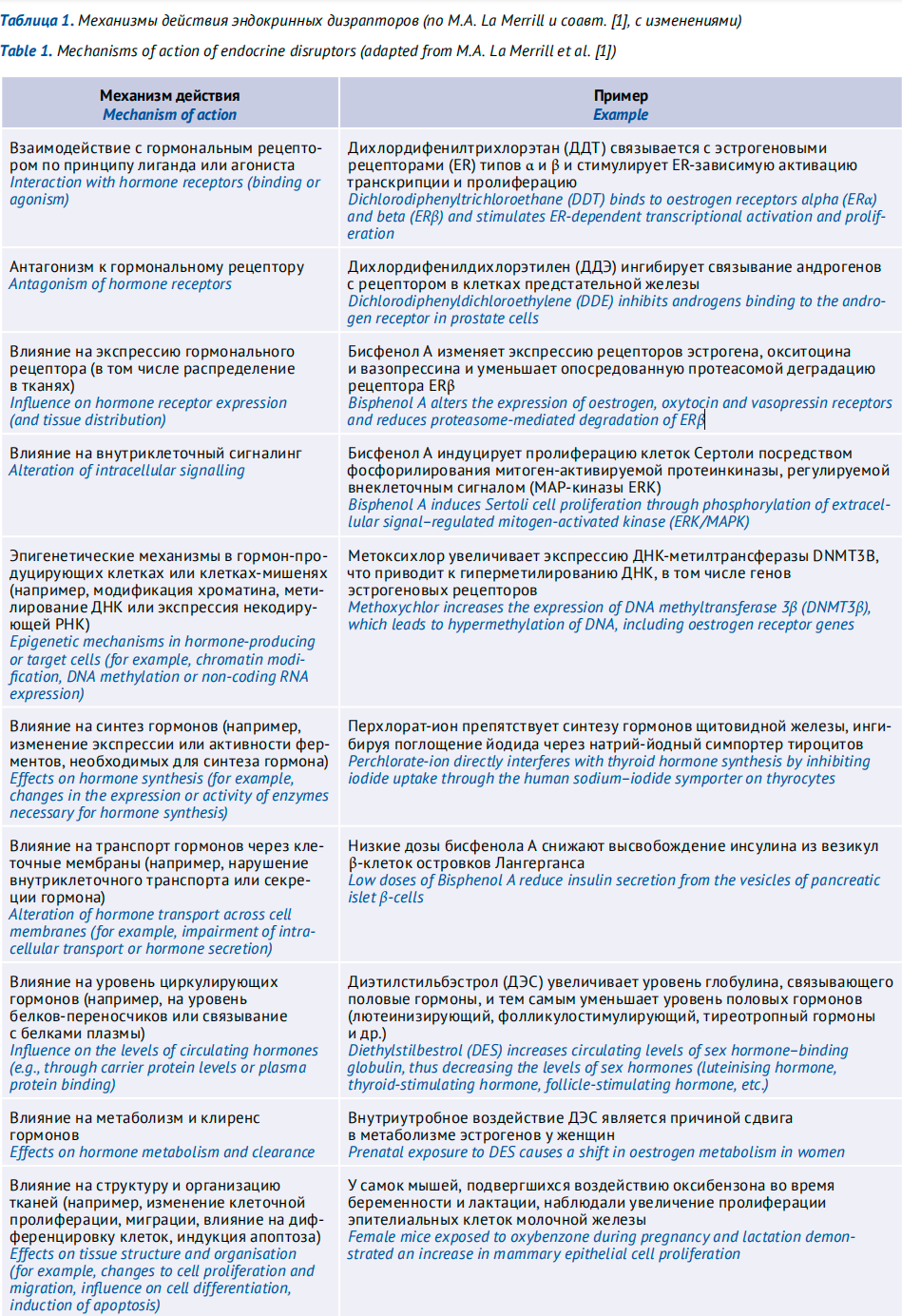
Как отмечают К. Л. Крышень с коллегами, большинство имеющихся публикаций по эндокринным дизрапторам содержат данные о веществах, применяемых в химической промышленности. Гораздо меньше освещены вопросы нарушений регуляции эндокринной системы, связанные с использованием негормональных лекарственных средств.
В 2018 году S. Sabir с соавторами представили читателям обобщённый материал по негормональным препаратам, влияющим на эндокринную систему (табл. 2) [9].
Таблица 2. Примеры ЛС, влияющих на эндокринную систему (по S. Sabir и соавт. [9])
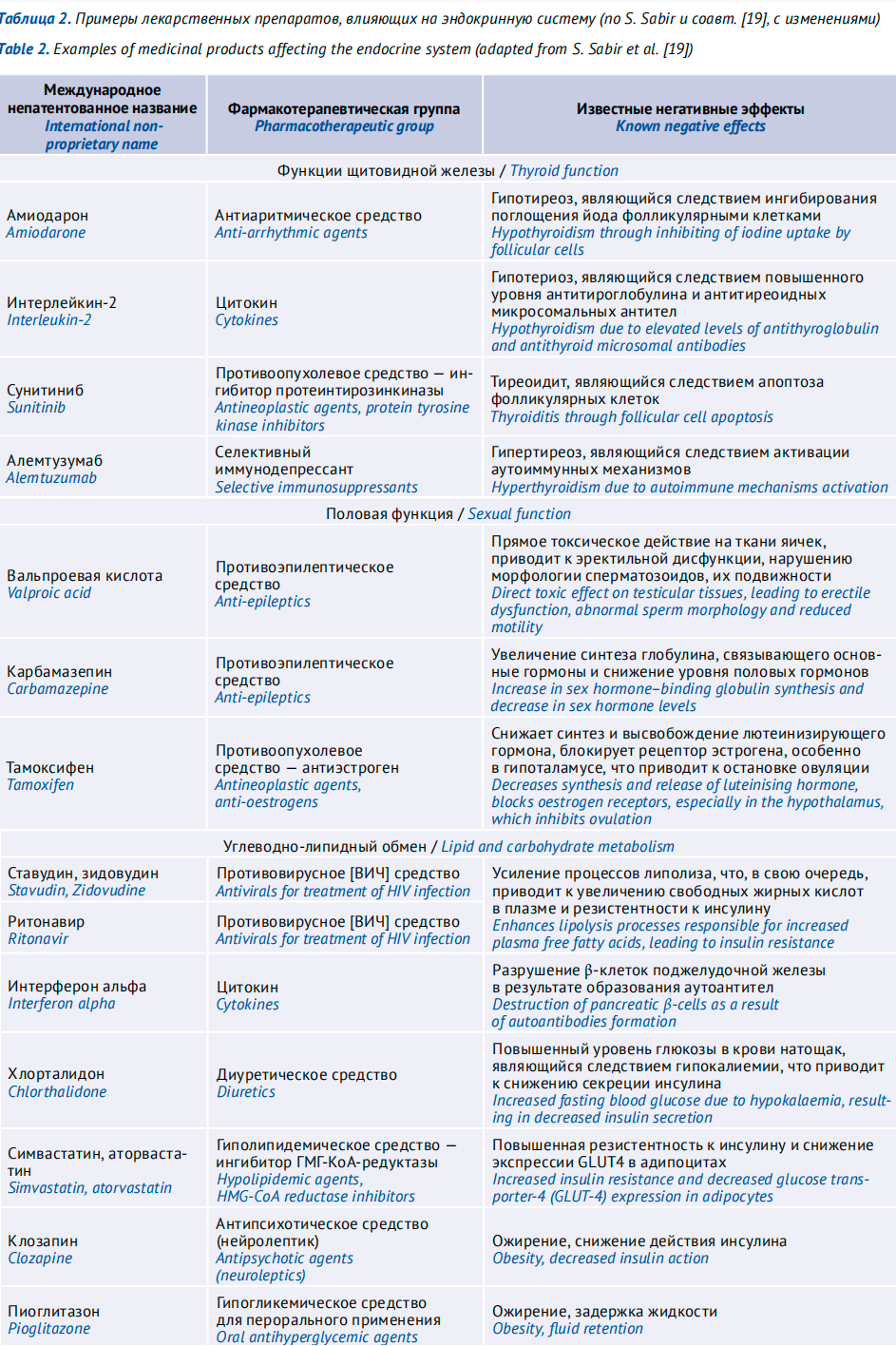
В перечень основных негормональных эндокринных дизрапторов входят антипсихотические, противоэпилептические, гипотензивные, противовирусные, противодиабетические и противоопухолевые лекарственные средства, которые могут влиять на синтез гормонов, способствовать увеличению риска развития сахарного диабета, вызывать изменение функции репродуктивной системы.
Регуляторные вопросы оценки безопасности эндокринных дизрапторов
В 1996 году Организацией экономического сотрудничества и развития (ОЭСР) организована группа по разработке руководства тестирования и оценки ЭД.
Документом, определяющим выявление химических агентов, влияющих на эндокринную систему, стало Руководство по оценке химических реагентов по воздействию на эндокринную систему (2012 г.). Оно служило для трактовки результатов тестов и сбора информации о том, может ли вещество быть эндокринным дизраптором [10].
В обновлённом Руководстве по оценке эндокринной токсичности (2018 г.) [11] ОЭСР была предложена поэтапная система оценки ЭД:
- Анализ данных о веществе (физико-химические, токсикологические свойства, метаболизм, прогнозы in silico).
-
Изучение механизмов эндокринных расстройств под влиянием химического вещества in vitro (взаимодействие с гормональными рецепторами, ферментными системами).
-
Подтверждение данных in vivo путём тестирования на грызунах [12].
-
Результаты общетоксикологических исследований (канцерогенность, токсичность при многократном введении на протяжении 28, 90 суток, репродуктивная токсичность на одном поколении и т. п.).
-
Расширенные сведения токсикологических исследований (углублённое исследование репродуктивной токсичности на одном поколении, репродуктивная токсичность на двух поколениях) [13].
Исследование токсичности на животных включает биохимический анализ крови, гистологическое исследование тканей, взвешивание органов. Так, в протоколе «90‑дневная токсичность на грызунах» [14], помимо стандартных лабораторных исследований, проводится определение уровней гормонов щитовидной железы: трийодтиронина (Т3), тироксина (Т4) и тиреотропного гормона (ТТГ).
Дополнительно определяют такие параметры, как уровни половых гормонов (тестостерона, эстрадиола, фолликулостимулирующего гормона (ФСГ), лютеинизирующего гормона (ЛГ)) и спермограмму [14].
В руководстве по доклинической оценке токсичности гормональных дизрапторов в отношении эндокринной системы, опубликованном FDA в 2015 году, указано, что на момент подготовки материала не было выявлено ни одного примера эндокринной токсичности, которую нельзя было бы распознать при помощи стандартного перечня доклинических исследований [15].
В этот перечень входят следующие испытания:
- скрининг взаимодействия ЛС с рецепторами, чувствительными к гормонам;
-
фармакологические исследования (эндокринная активность ЛС может быть выявлена во время экспериментов на моделях заболеваний человека, если фармакологическая мишень так или иначе захватывает систему эндокринной регуляции);
-
определение токсичности при множественном введении на 2 видах животных (грызунах и негрызунах);
-
анализ репродуктивной токсичности;
-
изучение канцерогенности.
При выявлении отрицательного влияния на эндокринную систему нужны дополнительные исследования для поиска механизма обнаруженных нарушений.
Одним из них может стать изменение активности изоферментов цитохрома P450 (CYP), так как некоторые из них участвуют в метаболизме стероидных гормонов. Аналогично печёночный фермент уридин-5‑дифосфат глюкуронилтрансфераза участвует в метаболизме гормонов щитовидной железы [15].
Уровни гормонов в крови животных как маркеры эндокринных нарушений
Различают 3 ведущие вертикальные оси гормональной регуляции:
- тиреотропная (гипоталамус — гипофиз — щитовидная железа);
-
гонадотропная (гипоталамус — гипофиз — половые железы);
-
кортикотропная (гипоталамус — гипофиз — кора надпочечников).
Как отмечают авторы исследования, изменения в одной оси могут вызывать изменения в других.
Так как гормональный фон животных и человека существенно различаются, то при определении уровней гормонов у животных нужно знать их нормальные показатели. В таблице 3 [16–48] приводятся эти значения.
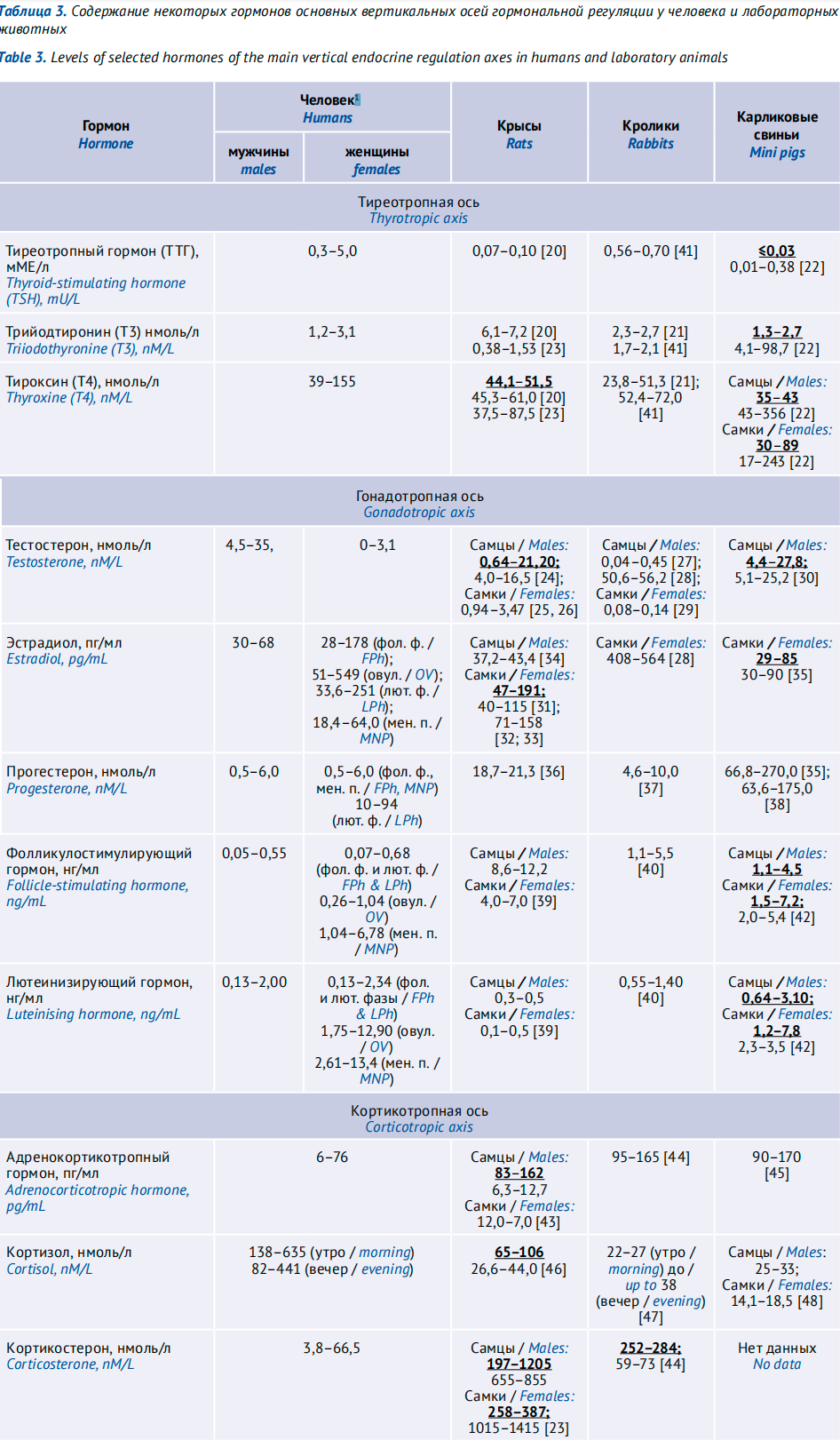
Оценка уровней гормонов должна проводиться в совокупности. Например, раньше для оценки гормонального статуса щитовидной железы определяли уровни ТТГ и Т4 (тироксин). Теперь выяснилось, что этого недостаточно и в дополнение к указанным параметрам рекомендуется определять уровень Т3 (трийодтиронин).
Интегральный тиреоидный индекс (ИТИ)
На основании этих показателей можно рассчитать интегральный тиреоидный индекс (ИТИ). Он представляет собой соотношение суммы гормонов щитовидной железы к тиреотропному гормону и в норме составляет 7,04–27,21 [46]. Изменение ИТИ свидетельствует о дисфункции щитовидной железы: интегральный тиреоидный индекс повышен при гипертиреозе, а понижен — при гипотиреозе.
Соотношение Т3, Т4 и ТТГ
Соотношение Т3 иТ4 помогает выявлять наличие тиреотоксикоза, синдрома эутиреоидной слабости, воздействие различных ЛС на функцию щитовидной железы [46–48]. При этом важно учитывать, какое должно быть соотношение Т3 к Т4, поскольку норма соотношения Т3 и Т4 у женщин, особенно во время беременности, может отличаться от стандартных референсных значений.
Из таблицы 3 наглядно видно, что уровень ТТГ у животных значительно ниже, чем у человека, тогда как уровни Т3 и Т4 сравнимы. Из-за этого определение Т3/Т4 более информативно для выявления нарушений функции щитовидной железы под действием ЛС. У самцов крыс уровни Т4 и ТТГ выше, чем у самок. С возрастом отмечается понижение уровней Т3 и Т4 [23].
Несмотря на различия в генотипе, у крыс часто выявляют эутиреоидный синдром и спонтанно возникающие доброкачественные опухоли щитовидной железы без каких‑либо клинических признаков [23, 49].
Анализ показателей гонадотропной оси свидетельствует о высокой вариабельности данных, особенно у самок (табл. 3).
Соотношение ЛГ и ФСГ
Практическое значение имеет соотношение гормонов ЛГ/ФСГ. У человека в детстве этот показатель составляет 1/1. С наступлением полового созревания уровень ЛГ становится выше, чем ФСГ. С окончанием полового созревания и до начала климакса уровень ФСГ в 1,5–2 раза ниже ЛГ. Рост показателя ЛГ/ФСГ > 2,5 может говорить о патологии яичников. Низкое соотношение ЛГ и ФСГ может указывать на снижение функции половых желез или нарушения в работе гипофиза. У мужчин уровень ФСГ всегда выше, чем ЛГ [50, 51].
Выбор лабораторных животных должен осуществляться в зависимости от поставленной задачи. Так, анализ изменения уровня половых и гонадотропных гормонов лучше выполнять на карликовых свиньях, так как длительность эстрального цикла у них (18–24 суток) наиболее близка к менструальному циклу у женщин. То же можно сказать и о соотношении фолликулярной и лютеиновой фазы [52].
По данным авторов работы, для изучения стресса целесообразнее использовать мышей и крыс. Главным гормоном стресса у этих животных, в отличие от человека, является кортикостерон [53, 54]. Его уровень отличается в зависимости от времени суток [53], сезона [55], поведенческой активности животных [54, 56–59], наличия или отсутствия стрессовых ситуаций и прочих факторов.
Заключение
В связи с накоплением достаточного количества данных об отрицательном воздействии химических веществ (включая лекарственные средства) на эндокринную систему, вопросы прогнозирования такого влияния приобретают всё большее значение.
Авторы исследования отмечают, что, учитывая разнообразие механизмов, с помощью которых эндокринные дизрапторы могут изменять гуморальную регуляцию, а также нелинейность зависимости «доза — эффект», необходим углублённый анализ рисков подобных изменений.
Международные требования и методические подходы к тестированию безопасности химических веществ и препаратов относительно эндокринной системы находятся на этапе формирования. Необходима дополнительная разработка национальных практических рекомендаций и руководств.
Исследователи рекомендуют включить определение уровней основных гормонов в биологических жидкостях в протоколы оценки общей и специфической токсичности как ранних маркеров гормональных нарушений, возникающих ещё до появления структурных изменений тканей и органов.
При планировании таких исследований нужно учитывать видовые особенности гуморальной регуляции. Многообразие моделей животных повысит информативность получаемых результатов.
Также, по данным авторов работы, необходимо создание внутрилабораторных норм (референтных интервалов) не только отдельных гормонов, но и их соотношений у разных видов экспериментальных моделей. Включение в доклинические исследования анализа уровней основных гормонов у животных поможет оценить риски потенциальных угроз ятрогенного происхождения без существенного повышения стоимости самих экспериментов.
Источники
- La Merrill MA, Vandenberg LN, Smith MT, Goodson W, Browne P, Patisaul HB, et al. Consensus on the key characteristics of endocrine-disrupting chemicals as a basis for hazard identification. Nat Rev Endocrinol. 2020;16(1):45–57. https://doi.org/10.1038/s41574-019-0273-8
- Lathers CM. Endocrine disruptors: a new scientific role for clinical pharmacologists? Impact on human health, wildlife, and the environment. J Clin Pharm. 2002;42(1):7–23. https://doi.org/10.1177/0091270002042001001
- Carson RL. Silent spring. Boston: Houghton Mifflin Co.; 1962.
- Соловьева ТА. «Безмолвная весна» Рэйчел Карсон и революция в общественном экологическом сознании XX века. В кн.: Человек, экология, культура: Современные практики и проблемы. Сборник научных трудов по материалам Международной молодежной научной конференции. Саратов; 2014. С. 206–11. [Solovyeva TA. Rachel Carson’s “Silent spring” and a revolution in public environmental awareness in the 20th century. In: Human, ecology, culture: modern practices and problems. Proceedings of the International Youth Scientific Conference. Saratov; 2014. P. 206–11 (In Russ.)].
- Cohn BA, La Merrill M, Krigbaum NY, Yeh G, Park JS, Zimmermann L, Cirillo PM. DDT exposure in utero and breast cancer. J Clin Endocrinol Metab. 2015;100(8): 2865–72. https://doi.org/10.1210/jc.2015-1841
- Newbold RR, Padilla-Banks E, Jefferson WN. Adverse effects of the model environmental estrogen diethylstilbestrol are transmitted to subsequent generations. Endocrinology. 2006;147(6 Suppl):11–7. https://doi.org/10.1210/en.2005-1164
- McLachlan JA, Newbold RR, Shah HC, Hogan MD, Dixon RL. Reduced fertility in female mice exposed transplacentally to diethylstilbestrol (DES). Fertil Steril. 1982;38(3):364–71. https://doi.org/10.1016/s0015-0282(16)46520-9
- Newbold RR, McLachlan JA. Vaginal adenosis and adenocarcinoma in mice exposed prenatally or neonatally to diethylstilbestrol. Cancer Res. 1982;42(5):2003-11, PMID: 7066910
- Sabir S, Akhtar MF, Saleem A. Endocrine disruption as an adverse effect of non-endocrine targeting pharmaceuticals. Environ Sci Pollut Res Int. 2019;26(2):1277–86. https://doi.org/10.1007/s11356-018-3774-4
- Guidance document on standardised test guidelines for evaluating chemicals for endocrine disruption. Paris: OECD; 2012.
- Revised guidance document 150 on standardised test guidelines for evaluating chemicals for endocrine disruption. Paris: OECD; 2018.
- Test No. 440: Uterotrophic bioassay in rodents: a short-term screening test for oestrogenic properties. Paris: OECD; 2007. Test No. 441: Hershberger bioassay in rats: a short-term screening assay for (anti)androgenic properties. Paris: OECD; 2009.
- Test No. 443: Extended one-generation reproductive toxicity study. Paris: OECD; 2018. Test No. 416: Two-generation reproduction toxicity study. Paris: OECD; 2018.
- Test No. 408: Repeated dose 90-day oral toxicity study in rodents. Paris: OECD; 2018.
- Nonclinical evaluation of endocrine-related drug toxicity. Guidance for industry. CDER; 2015.
- Северин СЕ, ред. Биохимия: учебник. М.: ГЭОТАР-Медиа; 2016.
- Тестостерон-ИФА-Бест. № Х-3972. Инструкция по применению. АО «Вектор-Бест». Новосибирск; 2012.
- Estradiol ELISA. Ref EAI-2693. Instructions for use. Version 14.0. DRG Instruments GmbH. Marburg; 2016. Прогестерон-ИФА-Бест. № X-3978. Инструкция по применению. АО «Вектор-Бест». Новосибирск; 2015.
- ФСГ-ИФА-Бест. № Х-3974. Инструкция по применению. АО «Вектор-Бест». Новосибирск; 2012. ЛГ-ИФА-Бест. № Х-3976. Инструкция по применению. АО «Вектор-Бест». Новосибирск; 2017.
- Сандаков ДБ, Семененя ИН, Гурин АВ. Изменение содержания некоторых гормонов в крови у крыс при центральном действии ингибиторов протеолиза и белкового синтеза. Проблемы эндокринологии. 1997;43(4):46–7. [Sandakov DB,
Semenenya IN, Gurin AV. The change in the content of certain hormones in the blood of rats under the central action of proteolysis inhibitors and protein synthesis. Problemy endokrinologii = Problems of Endocrinology. 1997;43(4):46–7 (In Russ.)] https://doi.org/10.14341/probl199743446-47
- Joseph LJ, Desai KB, Patel MC, Mehta MN, Ganatra RD. Thyroid function and thyrotropin levels in rabbits immunized to produce antibodies against thyroid hormones. Int J Rad Appl Instrum B. 1987;14(5):511–4. https://doi.org/10.1016/0883-2897(87)90119-x
- Yeom SC, Cho SY, Park CG, Lee WJ. Analysis of reference interval and age-related changes in serum biochemistry and hematology in the specific pathogen free miniature pig. Lab Anim Res. 2012;28(4):245–53. https://doi.org/10.5625/lar.2012.28.4.245
- Thorson L. Thyroid diseases in rodent species. Vet Clin North Am Exot Anim Pract. 2014;17(1):51–67. https://doi.org/10.1016/j.cvex.2013.09.002
- Диатроптов МЕ, Диатроптова МА, Кондашевская МВ. Анализ показателей инфрадианных ритмов стероидных гормонов и процентного содержания нейтрофилов периферической крови у крыс-самцов Вистар. Фундаментальные исследования. 2012;(9-2):273–7. [Diatroptov ME, Diatroptova MA, Kondashevskaya MV. Infradian rhythmic of the steroid hormones and peripheral blood’s neu trophiles percentage test in Wistar male rats. Fundamental’nye issledovaniya = Fundamental Research. 2012; (9-2):273–7 (In Russ.)]
- Кассим М, Синдеева ОА, Синдеев СС, Зинченко ЕМ, Уланова МВ, Гекалюк АС и др. Влияние эмоциональных и тяжелых патологических стрессов на уровень артериального давления и продукцию тестостерона у самок и самцов крыс. Известия Саратовского университета. Новая серия. Серия Химия. Биология. Экология. 2015;15(2):46–53. [Kassim M, Sindeeva OA, Sindeev SS, Zinchenko EM, Ulanova MV, Gekalyuk AS, et al. The effect of emotional and severe pathological stresses on the level of arterial pressure and the production of testosterone in female and male rats. Izvestiya Saratovskogo universiteta. Novaya seriya. Seriya Khimiya. Biologiya. Ekologiya = Izvestiya of Saratov University. Chemistry. Biology. Ecology. 2015;15(2):46–53 (In Russ.)]
- Косырева АМ, Джалилова ДШ, Макарова ОВ, Сладкопевцев АС. Морфофункциональные изменения тимуса и содержание субпопуляций лимфоцитов в крови у самок крыс Вистар с разной устойчивостью к гипоксии при системном воспалительном ответе. Медицинская иммунология. 2019;21(4):643– 52. [Kosyreva AM, Dzhalilova DSh, Makarova OV, Sladkopevtsev AS. Morpho-functional changes of thymus and contents of blood lymphocyte subpopulations in female Wistar rats with different resistance to hypoxia in systemic inflammatory response. Medical Immunology (Russia). 2019;21(4):643–52 (In Russ.)] https://doi.org/10.15789/1563-0625-2019-4-643-652
- Hilliard J, Pang CN, Penardi R, Sawyer СН. Effect of coitus on serum levels of testosterone and LH in male and female rabbits. Proc Soc Exp Biol Med. 1975;149(4): 1010–4. https://doi.org/10.3181/00379727-149-38945
- Zaima U, Anas Sarwar Q, Sarmad R, Misbah I, Tanzeela F, Saqib U. Effects of oral administration of black seed (Nigella sativa) oil on histomorphometric dynamics of testes and testosterone profile in rabbits. Pak J Pharm Sci. 2017;30(2):531–6. PMID: 28649080
- Котлярова АА, Щулькин АВ, Черных ИВ, Якушева ЕН. Особенности кроликов породы Шиншилла как тест-системы для изучения препаратов половых гормонов. Материалы Всероссийской научной конференции молодых ученых, посвященной 95-летию со дня рождения профессора А.А. Никулина. Рязань; 2018. C. 63–4. [Kotlyarova AA, Shchul’kin AV, Chernykh IV, Yakusheva EN. Special considerations for Chinchilla rabbits as a test system for studying sex hormone preparations. Proceedings of the All-Russian scientific conference of young scientists dedicated to the 95th anniversary of the birth of Professor A.A. Nikulin. Ryazan; 2018. P. 63–4 (In Russ.)]
- Myren CJ, Einer-Jensen N, Bennett P. The physiology of the testes in the Göttingen mini pig. Z Versuchstierkd. 1989;32(4):183–7. PMID: 2626885
- Faccio LA, Da Silva AS, Tonin AA. Serum levels of LH, FSH, estradiol and progesterone in female rats experimentally infected by Trypanosoma evansi. Experimental Parasitology. 2013;135(1):110-5. https://doi.org/10.1016/j.exppara.2013.06.008
- Mukaddam-Daher S, Jankowski M, Wang D, Menaouar A, Gutkowska J. Regulation of cardiac oxytocin system and natriuretic peptide during rat gestation and postpartum. J Endocrinol. 2002;175(1):211–6. https://doi.org/10.1677/joe.0.1750211
- Røste LS, Taubøll E, Isojarvi JIT, Berner A, Berg KA, Pakarinen AJ, et al. Gonadal morphology and sex hormones in male and female Wistar rats after longterm lamotrigine treatment. Seizure. 2003;12(8):621–7. https://doi.org/10.1016/s1059-1311(03)00056-6
- Мхитаров ВА. Влияние длительного потребления алкоголя в условиях свободного выбора на уровень половых гормонов. Российский медико-биологический вестник им. академика И.П. Павлова. 2010;18(1):44–8. [Mkhitarov VA. Effect of prolonged alcohol consumption in a free elections in the level of sex hormones. Rossiysky mediko-biologicheskiy vestnik im. akademika I. P. Pavlova = I.P. Pavlov Russian Medical Biological Herald. 2010;18(1):44–8 (In Russ.)]
- Peter B, De Rijk EPCT, Zeltner A, Emmen HH. Sexual maturation in the female Göttin gen minipig. Toxicol Pathol. 2016;44(3):482–5. https://doi.org/10.1177/0192623315621413
- Meijs-Roelofs НМ, de Greef WJ, Uilenbroek JT. Plasma progesterone and its relationship to serum gonadotrophins in immature female rats. J Endocrinol. 1975;64(2):329–36. https://doi.org/10.1677/joe.0.0640329
- Kriesten К, Murawski U. Concentrations of serum cortisol, progesterone, estradiol-17 beta, cholesterol and cholesterol ester in the doe during the reproductive stadium, in the fetal serum, in the amniotic fluid and in the milk of rabbits, as well as correlations between these parameters. Comp Biochem Physiol A Comp Physiol. 1988;90(3):413–20. https://doi.org/10.1016/0300-9629(88)90211-3
- Noguchi M, Ikedo T, Kawaguchi H, Tanimoto A. Estrus synchronization in microminipig using estradiol dipropionate and prostaglandin F2α. J Reprod Dev. 2016;62(4):373–8. https://doi.org/10.1262/jrd.2015-169
- Gharib SD, Wierman ME, Badger TM, Chin WW. Sex steroid hormone regulation of follicle-stimulating hormone subunit messenger ribonucleic acid (mRNA) levels in the rat. J Clin Invest. 1987;80(2):294–9. https://doi.org/10.1172/JCI113072
- Berger M, Jean-Faucher C, de Turckheim M, Veyssiere G, Blanc MR, Poirier JC, Jean C. Testosterone, luteinizing hormone (LH) and follicle stimulating hormone (FSH) in plasma of rabbit from birth to adulthood. Correlation with sexual and behavioural development. Acta Endocrinol (Copenh). 1982;99(3):459–65. https://doi.org/10.1530/acta.0.0990459
- Щулькин АВ, Якушева ЕН, Черных ИВ, Виноградов ИЮ, Попова НМ. Экспрессия гликопротеина P при экспериментальной дисфункции щитовидной железы. Клиническая и экспериментальная тиреоидология. 2015;11(3):11–6. [Shchul’kin AV, Yakusheva EN, Chernykh IV, Vinogradov IYu, Popova NM. P-glycoprotein expression in experimental thyroid dysfunction. Klinicheskaya i eksperimentalnaya tireoidologiya = Clinical and Experimental Thyroidology. 2015;11(3):11–6 (In Russ.)] https://doi.org/10.14341/ket2015311-16
- Noguchi М, Miura N, Ando T, Kubota Ch, Hobo S, Kawaguchi H, Tanimoto A. Profiles of reproductive hormone in the microminipig during the normal estrous cycle. In Vivo. 2015;29(1):17–22.
- Pitt JA, Buckalew AR, House DE, Abbott BD. Adrenocorticotropin (ACTH) and corticosterone secretion by perifused pituitary and adrenal glands from rodents exposed to 2,3,7,8-tetrachlorodibenzo-p-di-oxin (TCDD). Toxicology. 2000;151(1–3):25–35. https://doi.org/10.1016/s0300-483x(00)00257-2
- Monnier M, Desbals B. Dosage radio-immunologique de l’ACTH chez le lapin: relations stress ACTH-corticostéroïdes et diarrhées. Reprod Nutr Dev. 1985;25(6):1017–28. PMID: 3006192
- Tuchscherer M, Kanitz E, Puppe B, Tuchscherer A. Altered immunomodulation by glucocorticoids in neonatal pigs exposed to a psychosocial stressor. Pediatr Res. 2010;68(6):473–8. https://doi.org/10.1203/pdr.0b013e3181f70f08
- Горенко ИН, Киприянова КЕ, Типисова ЕВ. Тиреоидные гормоны и уровень антител у здоровых жителей Архангельской области. Экология человека. 2018;25(9):36–41. [Gorenko IN, Kipriyanova KE, Tipisova EV. Thyroid hormones and antibody level in healthy residents of the Arkhangelsk region. Ekologiya cheloveka = Human Ecology. 2018;25(9):36–41 (In Russ.)] https://doi.org/10.33396/1728-0869-2018-9-36-41
- Mortoglou A, Candiloros H. The serum triiodothyronine to thyroxine (T3/T4) ratio in various thyroid disorders and after Levothyroxine replacement therapy. Hormones (Athens). 2004;3(2):120–6. https://doi.org/10.14310/horm.2002.11120
- Гончаров НП. Значение и роль методов определения гормонов в развитии эндокринологии как общебиологической науки. Вестник Российской академии медицинских наук. 2012;67(3):42–9.
[Goncharov NP. Significance and role of hormone detection methods in the development of endocrinology as a biological discipline. Vestnik Rossiyskoy akademii meditsinskikh nauk = Annals of the Russian Academy of Medical Sciences. 2012;67(3):42–9 (In Russ.)] https://doi.org/10.15690/vramn.v67i3.184
- Campanha FVG, Perone D, de Campos DHS, Luvizotto R, De Síbio MT, et al. Thyroxine increases Serca2 and Ryr2 gene expression in heart failure rats with euthyroid sick syndrome. Arch Endocrinol Metab. 2016;60(6): 582–6. https://doi.org/10.1590/2359-3997000000208
- Saadia Z. Follicle stimulating hormone (LH: FSH) ratio in polycystic ovary syndrome (PCOS) — obese vs. non-obese women. Med Arch. 2020;74(4):289–93. https://doi.org/10.5455/medarh.2020.74.289-293
- Morshed MS, Banu H, Akhtar N, Sultana T, Begum A, Zamilla M. Luteinizing hormone to follicle-stimulating hormone ratio significantly correlates with androgen level and manifestations are more frequent with hyperandrogenemia in women with polycystic ovary syndrome. J Endocrinol Metab. 2021;11(1):14–21. https://doi.org/10.14740/jem716
- Bode G, Clausing P, Gervais F, Loegsted J, Luft J, Nogues V, Sims J. The utility of the minipig as an animal model in regulatory toxicology. J Pharmacol Toxicol Methods. 2010;62(3):196–220. https://doi.org/10.1016/j.vascn.2010.05.009
- Черкасова ОП, Федоров ВИ. Одновременное исследование содержания кортикостерона и 11-дегидрокортикостерона в надпочечниках и плазме крови при остром стрессе. Проблемы эндокринологии. 2001;47(1):37–9. [Cherkasova ОP, Fedorov VI. Simultaneous measurement of corticosterone and 11-dehydrocorticosterone in the adrenals and plasma in acute stress. Problemy endokrinologii = Problems of Endocrinology. 2001;47(1):37–9 (In Russ.)] https://doi.org/10.14341/probl11315
- Кондашевская МВ, Алексанкина ВВ, Артемьева КА, Болтовская МН. Сопоставление адаптивной способности старых и молодых крыс Вистар к стрессорному воздействию и острой гипоксической гипоксии. Бюллетень экспериментальной биологии и медицины. 2021;171(6):783–7. [Kondashevskaya MV, Aleksankina VV, Artemieva KA, Boltovskaya MN. Comparison adaptive capacity of old and young Wistar rats to stress exposure and acute hypoxic hypoxia. Byulleten’ ehksperimental’noi biologii i meditsiny = Bulletin of Experimental Biology and Medicine. 2021;171(6):783–7 (In Russ.)] https://doi.org/10.47056/0365-9615-2021-171-6-783-787
- Меркулов ВМ, Климова НВ, Меркулова ТИ. Внутрисуточный ритм секреции глюкокортикоидов и динамика генного ответа. Вавиловский журнал генетики и селекции. 2015;19(2):214–21. [Merkulov VM, Klimova NV, Merkulova TI. The ultradian rhythm of glucocorticoid secretion and the time course of target gene regulation. Vavilovskiy zhurnal genetiki i selektsii = Vavilov Journal of Genetics and Breeding. 2015;19(2):214–21 (In Russ.)]
- Умрюхин ПЕ, Григорчук ОС. Кортикостерон крови и ликвора у крыс с различным поведением в открытом поле при стрессорной нагрузке. Международный журнал прикладных и фундаментальных исследований. 2015;11(3):372– 4. [Umryukhin PE, Grigorchuk OS. Blood and liquor corticosterone level in the rats with different open field behavior: effects of the stress. Mezhdunarodny zhurnal prikladnykh i fundamental’nykh issledovaniy = International Journal of Applied and Fundamental Research. 2015;11(3):372–4 (In Russ.)]
- Гостюхина АА, Замощина ТА, Зайцев КВ, Гутор СС, Жукова ОБ, Светлик МВ и др. Адаптивные реакции крыс после световых десинхронозов и физического переутомления. Бюллетень сибирской медицины. 2018;17(3):22–34. [Gostyukhina AA, Zamoshchina TA, Zaitsev KV, Gutor SS, Zhukova OB, Svetlik MV, et al. Adaptive reactions of rats after light desynchronosis and physical overwork. Bulletin of Siberian Medicine. 2018;17(3):22–34 (In Russ.)] https://doi.org/10.20538/1682-0363-2018-3-22-34
- Viau V, Meaney MJ. Variations in the hypothalamic-pituitary-adrenal response to stress during the estrous cycle in the rat. Endocrinology. 1991;129(5):2503–11. https://doi.org/10.1210/endo-129-5-2503
- Louch CD, Higginbotham M. The relation between social rank and plasma corticosterone levels in mice. Gen Comp Endocrinol. 1967;8(3):441–4. https://doi.org/10.1016/s0016-6480(67)80006-6






 Катрен Стиль
Катрен Стиль 1.jpg)



зарегистрированным пользователям