Таблетки для Прометея
Нарушение функции печени как фактор риска развития нежелательных реакций — подробный разбор с перечислением препаратов
Нарушение печёночной функции — это состояние, кардинально влияющие на качество фармакотерапии и процесса лечения в целом. Его проявления варьируют от длительного бессимптомного течения до развития острой печёночной недостаточности, требующей оказания неотложной помощи. Российские учёные Остроумова О. Д. и Переверзев А. П. провели анализ и систематизацию зарубежных и отечественных источников по данному вопросу. Результаты их работы изложены в объёмной публикации «Нарушение печёночной функции как фактор риска развития нежелательных реакций». Мы предоставляем нашим читателям обзор этого научного труда. Его цель — информирование врачей, провизоров и фармацевтов о потенциальных рисках медикаментозной терапии, возникающих у пациентов с нарушением функции печени из‑за изменения фармакокинетики и фармакодинамики ЛС, а также о современных подходах к выбору и расчёту дозировки ЛС. Материал получился достаточно объёмным — при необходимости вы можете кликнуть на гиперссылку и перейти к другой части статьи, чтобы не тратить время на пролистывание.
Введение
Факторы, способствующие нарушению печёночной функции, весьма разнообразны. По данным исследования [1], проведённого в США с 1998 по 2008 гг., ведущими причинами нарушения функции печени являются:
- передозировка парацетамола (46 %);
- идиопатическое поражение функции печени (14 %);
- прочие ЛС (11 %);
- вирусный гепатит В (7 %);
- прочие инфекционные и неинфекционные болезни, вызывающие поражение печени (7 %);
- аутоиммунный гепатит (5 %);
- ишемический гепатит или инфаркт печени (4 %);
- вирусный гепатит А (3 %);
- болезнь Вильсона (2 %).
В работе французского исследователя P. Ichai и соавторов [2] показано, что с 1986 по 2006 гг. главными причинами нарушения функции печени были:
- вирусный гепатит В (29 %);
- ЛС кроме парацетамола (21 %);
- болезни, протекающие с поражением печени, не считая вирусных гепатитов А и В (21 %);
- идиопатическое нарушение функции печени (18 %);
- приём парацетамола (7 %);
- вирусный гепатит А (5 %).
Третье подобное исследование [3] было проведено B. Brandsaeter и соавторами в Скандинавских странах. В нем основными причинами нарушения функции печени были признаны:
- идиопатическое поражение (43 %);
- заболевания, протекающие с поражением печени за исключением вирусных гепатитов А и В (21 %);
- приём парацетамола (17 %);
- ЛС помимо парацетамола (10 %);
- вирусный гепатит В (8 %);
- вирусный гепатит А (2 %).
Таким образом, ведущими причинами нарушения печёночной функции являются инфекционные и неинфекционные заболевания, а также приём ЛС.
Из-за высокой смертности (до 85 %) пациентов с нарушением функции печени необходимо проведение комплексной терапии как для лечения основной патологии, так и для воздействия на сопутствующие заболевания, ставшие причиной вторичного поражения печёночных клеток [4].
Для подбора лекарственной терапии и оценки функционального состояния печени используется шкала Чайлда-Пью (табл. 1) [5, 6].
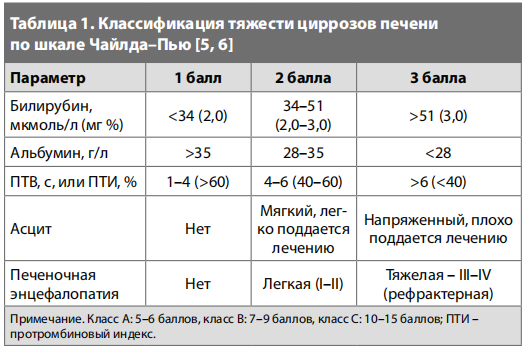
Однако её возможности ограничены. С помощью шкалы нельзя оценить способность печени к метаболизму и выведению отдельных ЛС или их комбинаций. Есть необходимость в разработке более усовершенствованных методов оценки функции печени.
Фармакодинамические и фармакокинетические изменения ЛС у пациентов с нарушением функции печени
Печень занимает ведущую роль в фармакокинетике ЛС. При недостаточности её функции снижается клиренс и элиминация препаратов, а также их связывание с белками плазмы крови, из‑за чего нарушается транспорт и выведение ЛС.
Для лечения портальной гипертензии у пациентов с циррозом печени часто проводится порто-системное шунтирование. Эта манипуляция способствует уменьшению пресистемной элиминации ЛС и улучшению их абсорбции.
В печени проходят основные процессы метаболизма лекарственных препаратов. Нарушение функции этого органа изменяет активность ферментов цитохрома Р450 (CYP450).
Нередко при циррозе печени встречается такая коморбидная патология, как нарушение почечной функции, что делает необходимым коррекцию дозы медикаментов. Помимо этого, у пациентов с циррозом изменяется фармакокинетика ЛС, например, уменьшается эффективность β-адреноблокаторов (β-АБ), диуретиков, опиатов и др.
Влияние нарушения печёночной функции на фармакокинетику ЛС
При печёночной недостаточности нарушаются все фармакокинетические процессы: абсорбция, распределение, метаболизм, элиминация. Разберём каждый из них более подробно.
Абсорбция
Патология печени нередко сопровождается расстройством функции пищеварительного тракта, например, увеличением проницаемости стенки кишечника. Это способствует появлению энцефалопатии и других осложнений, особенно у пациентов с циррозом [7, 8].
Вышеназванная особенность не является ведущей в корреляции абсорбции ЛС. Изменения биодоступности лекарственных средств, вводимых перорально, возникают из‑за снижения пресистемного метаболизма [9].
При циррозе печени уменьшается активность группы изоферментов CYР450, участвующих в метаболизме ЛС (таких, как хлорметиазол, карведилол, лабеталол, метопролол, мидазолам, морфин, нифедипин). Это ведёт к повышению их биодоступности при пероральном приёме [10].
В исследовании P. Pentikäinen и соавторов продемонстрировано, что при циррозе печени биодоступность хлорметиазола повышается более, чем в 10 раз [11].
Улучшения биодоступности ЛС вместе со снижением клиренса приводит к необходимости понижать их дозу. Так, приём карведилола при циррозе начинают с 1/5 от обычной дозы с дальнейшей титрацией [12].
Как уже упоминалось, при циррозе печени часто проводят портосистемное шунтирование (TIPS — transjugular intrahepatic porto-systemic shunt). Операция способствует коррекции портальной гипертензии и признаков асцита, снижению риска развития кровотечений из варикозно-расширенных вен пищевода.
Постановка шунтов уменьшает метаболизм ЛС и повышает их биодоступность за счёт снижения печёночного кровотока. N. Chalasani и соавторы продемонстрировали, что биодоступность мидазолама при пероральном приёме повышена у пациентов с циррозом печени, имеющих в анамнезе TIPS (0,76±0,20), по сравнению с контрольной группой пациентов с патологией печени без операции (0,27±0,14) и здоровыми людьми (0,30±0,10) [13].
После употребления мидазолам подвергается пресистемному метаболизму изоферментом CYP3A в стенке кишечника и печени. Метаболизм в кишечной стенке является ведущим фактором, определяющим биодоступность препарата при приёме внутрь [14].
Значительное уменьшение метаболизма ЛС у пациентов с циррозом печени после шунтирования было связано со снижением активности CYP3A в кишечнике. Таким образом пациенты с циррозом печени, перенёсшие TIPS, являются группой риска по передозировке и развитию нежелательных реакций (НР) и нуждаются в коррекции дозы ЛС [9].
Иногда у пациентов с нарушением печёночной функции биодоступность ЛС не растёт, а падает. Например, у пациентов с холестазом снижается всасывание жирорастворимых витаминов (A, D, E, K). Это может вызвать развитие дефицит-ассоциированных состояний [15].
Распределение
Установлено, что терапевтический эффект оказывает та часть ЛС, которая находится в свободном, не связанном с белками плазмы крови, состоянии [16]. Изменение степени связывания ЛС с альбуминами при циррозе является фактором, определяющим эффективность и безопасность медикаментозного лечения.
У пациентов с хроническими заболеваниями печени фракция ЛС, не связанная с белками плазмы крови, оказывается выше, чем у здоровых лиц. Это происходит из‑за снижения синтеза и структурных изменений альбумина, α1‑кислого гликопротеина, а также из‑за накопления продуктов обмена веществ (билирубина), препятствующих связыванию ЛС с белками плазмы [16, 17].
Всё это приводит к увеличению объёма распределения некоторых ЛС (преимущественно водорастворимых). Так, пациентам с асцитом требуется назначение больших нагрузочных доз аминогликозида. Объём распределения цефодизима у пациентов с циррозом печени в 3 раза больше, чем у здоровых лиц [15, 18].
Примечательно, что увеличение объёма распределения больше характерно для пациентов с хронической, а не острой патологией печени [17].
В своей работе R. Williams и соавторы изучали особенности метаболизма напроксена у пациентов с циррозом печени [19]. Выяснилось, что свободная фракция препарата, не связанная с белками плазмы крови, увеличивалась в 2–4 раза по сравнению со здоровыми людьми наряду со снижением связанной фракции.
Такая особенность привела к выраженному (на 60 %) снижению соотношения «клиренс свободной фракции/биодоступность напроксена (Clunbound/F)», а также к увеличению объёма распределения ЛС [19].
Элиминация
Метаболизм
У пациентов с хронической патологией печени изменяется метаболизм (в основном ферментов I фазы и реже ферментов II фазы) ЛС из‑за нарушения кровотока и ишемии гепатоцитов [20–22]. Степень таких изменений пропорциональна степени нарушения печёночной функции [23–27].
Так, в исследованиях A. Adedoyin и соавторов [28], R. Branch и соавторов [29] было продемонстрировано, что у пациентов с хронической патологией печени лёгкой и средней степени тяжести клиренс S-мефенитоина существенно снижался (до 20 %), а клиренс дебризохина не изменялся по отношению к исходным данным [28, 29].
Метаболизм S-мефенитоина осуществляется при помощи CYP2C19, а дебризохин метаболизируется с участием CYP2D6. На основании этого можно предполагать, что у исследуемых пациентов изменение активности CYP2C19 было более выраженно, чем CYP2D6.
В исследовании R. Frye и соавторов [30] для определения изменений активности изоферментов CYP450 пациентам с патологией печени и здоровым лицам давали для приёма внутрь комбинацию ЛС (кофеин, мефенитоин, дебризохин и хлорзоксазон), являющихся маркерами для изучения колебаний активности CYP1A2, CYP2C19, CYP2D6 и CYP2E1 соответственно.
Выявлено, что для ранней стадии болезней печени характерно снижение клиренса ЛС, метаболизирующихся CYP2C19, в то время как клиренс ЛС, метаболизирующихся CYP1A2, CYP2D6 и CYP2E1, менялся незначительно в сравнении с аналогичными показателями у здоровых лиц.
Для терминальной стадии печёночных заболеваний, наоборот, характерно уменьшение клиренса ЛС, метаболизирующихся CYP1A2, CYP2C19, CYP2D6 и CYP2E1 [30].
Для реакций конъюгации (например, глюкоронирования) у пациентов с патологией печени изменения менее присущи в сравнении с реакциями, опосредованными CYP450 [31–33].
Такая закономерность была показана в исследованиях бензодиазепинов: клиренс оксазепама, лоразепама и темазепама, элиминирующихся с помощью глюкуронизации, не понижался у пациентов с циррозом печени, тогда как клиренс диазепама и мидазолама, метаболизирующихся с помощью изоферментов I фазы, существенно снижался [32, 34–38].
Достоверная причина подобных изменений не определена. Это может быть связано с активацией фермента уридин-5‑дифосфат-глюкуронилтрансферазы (УДФ-ГТ, Uridine 5’ — diphospho-glucuronosyltransferase — UGT) [32], или с увеличением его активности в оставшихся жизнеспособных гепатоцитах [39], или с повышением внепеченочной глюкуронизации [38, 40] у пациентов с нарушением печёночной функции.
В более поздних работах продемонстрировано снижение глюкоронизации ряда ЛС (морфин, дифлунизал, лорметазепам, оксазепам, ламотриджин, зидовудин и микофенолата мофетил) у пациентов на поздних стадиях цирроза печени [41–47].
Скорее всего в более ранние исследования попали пациенты с лёгкой и умеренной степенью нарушения печёночной функции [32]. Не исключено также, что патология печени по‑разному действует на активность различных форм УДФ-ГТ, как это было представлено для изоферментов CYP450 [25].
Congiu и соавторы изучали изменение уровней матричной РНК разных изоформ УДФ-ГТ в гистологических срезах печени пациентов с фиброзом разной степени выраженности [48].
Авторы не отметили уменьшения матричной РНК УДФ-ГТ или его отдельных изоформ, однако выявили наличие потенциальной возможности уменьшения глюкуронизации ЛС в печени при наличии в ней активного воспаления [48].
Экскреция
Экскреция с жёлчью
Снижение клиренса ЛС из‑за нарушения их экскреции с жёлчью часто встречается у пациентов с холестазом [49]. Причина этого может быть, как внепеченочной (холелитиаз, склерозирующий холангит, рак желчевыводящих путей или поджелудочной железы), так и внутрипеченочной (функциональные нарушения секреторной функции печени).
Ряд исследований [50–55] показал, что у пациентов с обструкцией желчевыводящих путей нарушена экскреция с жёлчью некоторых антибиотиков (ампициллина, пиперациллина, цефалоспоринов, клиндамицина, ципрофлоксацина). Это может привести к их чрезмерному накоплению и повышению рисков развития НР.
Помимо этого, закупорка желчевыводящих путей может вызвать уменьшение метаболического клиренса ЛС из‑за повреждения клеток печени.
J. George и соавторы [23] в своей работе продемонстрировали уменьшение активности нескольких CYP (например, CYP2C и CYP2E1) в гистологических срезах печени, взятых у пациентов с терминальной стадией цирроза с холестазом и без него. Активность CYP3A снижалась только у пациентов без холестаза [23].
Почечная экскреция
Прогрессирующая почечная недостаточность (ПН), развивающаяся у пациентов с хронической печёночной патологией, известна под названием гепаторенальный синдром.
Такое заключение ставится, когда отсутствуют клинические, лабораторные, анатомические признаки других причин развития ПН. При этом снижается почечная экскреция некоторых ЛС: диуретиков (фуросемид, буметанид), антагонистов Н2‑рецепторов (циметидин, ранитидин), леветирацетама и других [56–61].
G. Granneman и соавторы [61] в своей работе продемонстрировали, что у пациентов с циррозом печени и нарушением функции почек почечный клиренс темафлоксацина снижался более чем наполовину (54 %).
Полученные результаты говорят о том, что у пациентов с нарушенной печёночной функцией следует проводить коррекцию дозы ЛС, выводимых не только печенью, но и почками.
Приводимая О. Д. Остроумовой и А. П. Переверзевым Таблица демонстрирует примеры изменения фармакокинетических параметров ЛС у пациентов с нарушением функции печени.

Фармакодинамические изменения ЛС у пациентов с нарушением печёночной функции
У пациентов с патологией печени, помимо изменения фармакокинетики, меняется ещё и фармакодинамика ЛС. Это может происходить из‑за нарушения связывания с рецепторами или изменения внутренней активности медикаментов (связавшись с рецептором, разные ЛС демонстрируют разную способность вызывать эффект, т. е. внутреннюю активность).
Наиболее яркие фармакодинамические изменения у пациентов с циррозом печени отмечаются при приёме β-адреноблокаторов (пропранолола, метипранолола), диуретиков (фуросемида, триамтерена, торасемида, буметамида), опиоидных анальгетиков, анксиолитиков и седативных средств [9].
Например, у пациентов с циррозом печени, в сравнении с пациентами без патологии печени, отмечалось снижение терапевтической эффективности β-адреноблоктаоров, диуретиков и увеличение терапевтической эффективности, потенциального риска развития НР и лекарственноиндуцированных заболеваний при приёме анальгетиков, анксиолитиков и седативных средств [9, 57, 62–66].
Уменьшение терапевтической эффективности β-адреноблокаторов у пациентов с циррозом печени было обусловлено понижением плотности и чувствительности β-адренорецепторов в мононуклеарных клетках [62, 67], а уменьшение терапевтической эффективности диуретиков — снижением числа действующих нефронов [68].
У пациентов с циррозом печени повышена терапевтическая эффективность при приёме опиоидных анальгетиков, анксиолитиков и седативных средств. Это увеличивает риск развития печёночной энцефалопатии [69–71].
Точная этиология такого явления не известна. Предполагается, что способствовать усилению эффективности могут следующие факторы:
- повышение проницаемости гематоэнцефалического барьера;
- увеличение тонуса γ-аминомаслянокислотно (ГАМК) — ергической системы;
- рост числа ГАМК-рецепторов [72].
Примеры ЛС, требующих особого внимания при приёме пациентами с нарушением печёночной функции
ЛС с анальгетической активностью
По данным О. Д. Остроумовой и А. П. Переверзева, на сегодняшний день нет чётких рекомендаций по режиму дозирования и выбора анальгетиков у пациентов с патологией печени. Имеющиеся литературные данные об их безопасности и эффективности весьма ограничены.
Опиоиды
Группа наркотических анальгетиков, назначаемых пациентам с выраженным болевым синдромом.
Морфин
В ходе метаболизма образуется 2 промежуточных продукта: морфин-3‑глюкуронид (M3G) и морфин-6‑глюкуронид (M6G).
M6G — вещество с высокой анальгетической активностью, превышающей эффективность самого морфина. M3G не обладает анальгетическими свойствами, но вызывает такие нейротоксические НР, как спутанность сознания.
У пациентов с нарушенной печёночной функцией из‑за снижения клиренса и/или увеличения периода полувыведения возможна кумуляция морфина. Для предупреждения развития осложнений рекомендуется назначение меньших доз сначала с сохранением обычной кратности введения, а при прогрессировании заболевания — с увеличением интервалов между введениями [73–77].
Оксикодон
Метаболизм осуществляется с помощью изоферментов CYP2D6 и CYP3A4 до 2 метаболитов, не обладающих анальгетической активностью.
При печёночной недостаточности происходит увеличение максимальной концентрации оксикодона на 40 %, а периода полувыведения этого препарата — до 4,6–24,4 ч (в среднем — 14 ч).
Для предупреждения развития НР у пациентов с печёночной недостаточностью снижают начальную дозу оксикодона до 30–50 % от стандартной [73–77].
Кодеин и меперидин
Оба ЛС не рекомендуются пациентам с печёночной недостаточностью.
Кодеин — пролекарство, которое метаболизируется в печени до морфина при помощи фермента CYP2D6. При нарушении печёночной функции этот процесс нарушается, поэтому снижается эффективность контроля боли.
Меперидин превращается в печени в нормеперидин при помощи фермента CYP3A4. При патологии печени снижается клиренс ЛС и удлиняется его период полувыведения. Это повышает риск развития НР, включая судорожный синдром [73–77].
Гидроморфон и гидрокодон
Гидроморфон метаболизируется в печени с образованием продуктов, не обладающих анальгетическими свойствами, но имеющих нейротоксическое действие.
Гидрокодон — пролекарство. С помощью фермента CYP2D6 превращается до гидроморфона и других продуктов метаболизма. Применяется в сочетании с неопиоидами (парацетамолом) при болевом синдроме.
Пациентам с патологией печени начальные дозы каждого из этих ЛС уменьшают в 2 раза. При прогрессировании нарушения функции печени для предупреждения риска развития НР увеличивают интервал между введениями доз [73–77].
Фентанил
Метаболизм ЛС происходит при помощи фермента CYP3A4 [73, 75]. Исследования показали, что однократное введение препарата не приводило к существенным изменениям фармакокинетики, однако при применении более высоких доз и при повторном введении фентанила отмечалось увеличение периода полувыведения.
По мнению некоторых экспертов, фентанил является препаратом выбора среди опиоидов для купирования боли у пациентов с нарушением печёночной функции [73, 75].
Назначение слишком низких доз опиоидов из‑за боязни осложнений может привести к недостатку обезболивания и ухудшению состояния пациента. Именно поэтому упор делается на тщательный выбор анальгетического средства. Предпочтение следует отдавать препаратам короткого действия (фентанил). Начинать лечение нужно с низких доз с последующей титрацией. Терапию следует проводить под контролем биохимических маркеров функции печени (билирубин, трансаминазы, ПТВ) [78–83].
Парацетамол
Препарат является одним из наиболее популярных средств для купирования боли. Применяется как в качестве монотерапии, так и в сочетании с опиоидами [79, 84].
У пациентов с нарушением функции печени снижается активность метаболизма и увеличивается период полувыведения парацетамола. Это повышает риск развития НР [84].
Метаболизм парацетамола осуществляется в печени с участием ферментов CYP2E1 и CYP450 до N-ацетил-пара-бензохинонимина (N-Acetyl-p-benzochinonimin, NAPQI). Этот продукт обладает гепатотоксичностью.
У здоровых лиц NAPQI конъюгирует с глутатионом, в результате чего его токсичность снижается. У пациентов с патологией печени уровень глутатиона снижен, соответственно увеличиваются риски токсического воздействия NAPQI [83].
Пациентам с печёночной недостаточностью не рекомендовано назначение парацетамола из‑за увеличения периода его полувыведения. В крайнем случае максимальная суточная доза не должна превышать 2 г [79].
Нестероидные противовоспалительные средства (НПВС)
Основная часть НПВС метаболизируется в печени с образованием промежуточных продуктов, обладающих гепатотоксичностью [79, 82, 85].
Чётких рекомендаций по выбору и коррекции дозы НПВС у пациентов с патологией печени нет. Важно не забывать, что хроническая недостаточность печени часто сопровождается нарушением почечной функции, что может способствовать ещё большей аккумуляции НПВС в крови и увеличению токсичности.
При варикозном расширении вен пищевода повышенное содержание НПВС повышает риск развития кровотечения [81].
Как отмечают О. Д. Остроумова и А. П. Переверзев, при назначении НПВС пациентам с патологией печени нужно быть крайне осторожными. Важно наблюдать за пациентом, проводить контроль АД, уровня гемоглобина, гематокрита и количества тромбоцитов [79, 81, 82, 84].
Седативные ЛС
Качественная седация лежит в основе лечения и ухода за тяжелобольными пациентами. Для этой цели часто используют пропофол и бензодиазепины.
У пациентов с патологией печени не происходит существенного изменения метаболизма пропофола. Отмечается замедление его выведения у пациентов в тяжёлом состоянии, но необходимости в коррекции дозы чаще всего не возникает [79].
Бензодиазепины
Группа препаратов, изменение метаболизма которых отличается в зависимости от конкретного ЛС.
Снижение интенсивности метаболизма мидазолама у пациентов с нарушением печёночной функции приводит к кумуляции этого препарата и росту риска развития НР [82].
Диазепам у пациентов с циррозом печени метаболизируется медленнее, продукты метаболизма скапливаются в крови, период полувыведения увеличивается. Это приводит к усилению седативного эффекта и нарастанию признаков энцефалопатии. Пациентам с патологией печени рекомендуется применять более низкие дозы этого препарата [81–83].
Препаратом выбора у пациентов с недостаточностью функции печени является лорезепам, так как его метаболизм в таком случае мало меняется.
Антибиотики
При печёночной недостаточности снижается фракция препаратов, связанная с белками, повышается свободная фракция. Увеличивается период полувыведения. Всё это ведёт к увеличению риска развития НР [85, 86, 87].
Помимо этого, сложно предугадать эффективность антибиотикотерапии из‑за колебания концентрации ЛС в сыворотке крови. Это относится к ванкомицину и аминогликозидам (тобрамицин, гентамицин и амикацин) [85].
При асците увеличивается риск аккумуляции антибиотиков. Для предупреждения НР при этой патологии рекомендуется назначение больших доз ЛС с увеличением интервалов между введениями.
Должно проводиться наблюдение за состоянием пациента, в том числе контроль почечной функции (диурез и уровень креатинина в сыворотке крови), динамики асцита и уровня биохимических маркеров, отражающих печёночную функцию.
Антикоагулянты (гепарин, эноксапарин, варфарин, аргатробан и др.)
Препараты данной группы часто назначают пациентам, получающим лечение после интенсивной терапии, для профилактики и лечения тромботических осложнений.
Метаболизм различных представителей антикоагулянтов при патологии печени меняется в разной степени [88–91].
Для контроля безопасности и эффективности этой группы препаратов у пациентов с печёночной недостаточностью рекомендуется определять в динамике следующие лабораторные показатели: уровень фактора Ха в сыворотке крови, ПТВ, число тромбоцитов и уровень гемоглобина [88–91].
Варфарин под влиянием изоферментов CYP450 метаболизируется в печени. Для него характерен высокий уровень связи с альбумином сыворотки крови. При нарушении печёночной функции снижается скорость метаболизма варфарина, что может стать причиной снижения его эффективности.
В то же время, при расстройстве функции печени снижается число тромбоцитов и нарушается синтез витамин-К-зависимых факторов свёртывания крови, что приводит к повышению риска кровотечения.
Вместе это благоприятствует лабильности международного нормализованного отношения у пациентов с нарушением печёночной функции.
Прямые пероральные антикоагулянты (дабигатран, ривароксабан, апиксабан)
Противопоказания к приёму:
- состояния, сопровождающиеся повышенным риском кровотечений (язва ЖКТ, варикозное расширение вен пищевода);
- нарушение печёночной функции;
- патология печени, которая может повлиять на выживаемость (дабигатран) или сопровождается коагулопатией (ривароксабан), нарушениями в свёртывающей системе крови (апиксабан).
С осторожностью эту группу ЛС назначают при нарушении функции почек, которое нередко встречается у пациентов с печёночной недостаточностью.
Противопоказанием к приёму дабигатрана является уровень клиренса креатинина <30 мл/мин, а к приёму апиксабана и ривароксабана <15 мл/мин [92].
Пациентам с гепарининдуцированной тромбоцитопенией назначают антикоагулянт аргатробан (препарат не зарегистрирован в нашей стране) [91], представляющий собой прямой ингибитор тромбина.
При печёночной недостаточности метаболизм и выведение ЛС нарушается, что ведёт к увеличению риска развития кровотечений. В связи с этим рекомендовано начинать инфузию аргатробана с более низкой дозы, проводить её под контролем активированного частичного тромбопластинового времени и в случае необходимости корректировать дозу [91].
В таблице 3 О. Д. Остроумова и А. П. Переверзев дают рекомендации по подбору дозирования ЛС при нарушении печёночной функции.
16 февраля 2023
Текст: Светлана Маляева
Фото: © vitalio333 / Фотобанк Фотодженика
Выпуск: №230, февраль 20234217 просмотров
4217 просмотров
Поделиться ссылкой с друзьями ВКонтакте Одноклассники
Нашли ошибку? Выделите текст и нажмите Ctrl+Enter.

 Катрен Стиль
Катрен Стиль 1.jpg)

зарегистрированным пользователям