Аменорея и гирсутизм у молодой женщины
Пациентка с аменореей и усиленным ростом волос на лице обратилась к гинекологу
По материалам:Androgen secreting steroid cell tumor of the ovary in a young lactating women with acute onset of severe hyperandrogenism: a case report and review of literature
Altaf Gauhar Haji, Shekhar Sharma, Manoj Babu, DK Vijaykumar and K Chitrathara
Journal of Medical Case Reports 2007, 1:182
На прием к врачу обратилась 22‑летняя женщина с жалобами на отсутствие менструации и резкое усиление роста волос на лице в течение последних четырех месяцев. Из анамнеза известно, что после рождения ребенка и последующей лактационной аменореи, продолжавшейся 8 месяцев, менструальный цикл восстановился и в течение 6 месяцев был регулярным. При осмотре у пациентки отмечалось выраженное оволосение в области подбородка, грудной клетки и на руках; при гинекологическом осмотре выявлена клиторомегалия. УЗИ органов брюшной полости и малого таза показало наличие правостороннего объемного образования в области придатков размером 51×54×58 мм с васкуляризацией от умеренной до значительно повышенной. Признаков асцита, ретроперитонеальной лимфаденопатии, увеличения надпочечников или метастазов в печени не наблюдалось. Определение онкомаркеров и гормонального статуса выявило у пациентки высокий уровень сывороточного тестостерона (таблица 1).
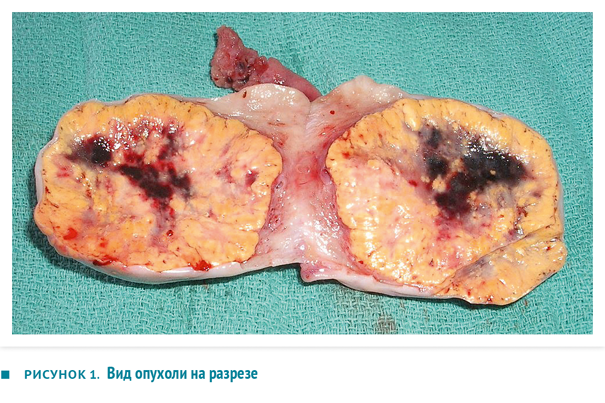
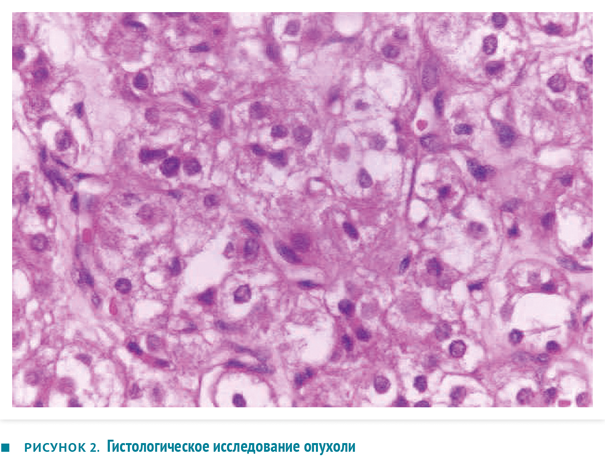
При проведении диагностической лапаротомии в области правого яичника обнаружено инкапсулированное опухолевидное образование размером 5×5 см желто-коричневого цвета, не спаянного с окружающими органами, кровоснабжавшееся сосудами яичника. Тяжесть патологического процесса (ограниченность опухоли одним яичником и отсутствие асцита) соответствовала стадии IA по классификации опухолей яичников. Учитывая стадию, а также низкую частоту (6 %) развития двустороннего поражения, пациентке была проведена односторонняя сальпингоовариоэктомия. На разрезе ткань опухоли выглядела солидной массой желтоватого цвета с выраженной капсулой и геморрагическими очагами (рисунок 1). Согласно данным гистологического анализа, в удаленном образовании определялись большие клетки полигональной формы с вакуолизированной цитоплазмой и полиморфными ядрами (рисунок 2). Кристаллы Рейнке, характерные для хилусно-клеточных опухолей из клеток Лейдига, не обнаружились. Иммуногистохимия выявила в ткани опухоли виментин (маркер мезенхимальных клеток во время раннего эмбрионального развития) и рецепторы к гонадотропину, реакция на альфа-фетопротеин и эпителиальный мембранный антиген — отрицательная. Эти данные позволили установить диагноз стероидноклеточной опухоли яичника.
Через два месяца после операции у пациентки восстановился менструальный цикл, нормализовался уровень свободного тестостерона (0,262 нг/мл), исчезло патологическое оволосение на лице и теле. Для контроля за возникновением рецидива пациентка в настоящее время регулярно проходит скрининговые исследования гормонального статуса.
Обсуждение
Менее 0,1 % всех случаев новообразований яичников приходится на стероидноклеточные опухоли, относящиеся к группе опухолей стромы полового тяжа. Стероидноклеточные опухоли яичника сопровождаются андрогенными изменениями не более чем в половине всех случаев, причем изменения накапливаются постепенно [1, 3–6]. Представленный клинический случай отличается внезапным возникновением аменореи и формированием признаков вирилизации за короткий промежуток времени.
Долгое время из‑за отсутствия четких представлений о происхождении стероидноклеточной опухоли не было единого мнения о том, к какой группе новообразований ее отнести [1–3, 5]. Было высказано предположение о происхождении опухоли из коры надпочечника, которая находится рядом с яичником [7]. В качестве аргумента сторонники этой гипотезы приводили тот факт, что в клетках опухоли обнаружены мРНК стероидотрансформирующих цитохромов Р450с11 и Р450с21, характерных для ткани надпочечников.
Большинство стероидноклеточных опухолей яичника имеют доброкачественный характер или низкую степень злокачественности. Однако у 20 % больных возникают метастазы, чаще всего в брюшную полость [2, 9]. Наблюдения, проведенные авторами из Массачусетского госпиталя (США) на 63 женщинах со стероидноклеточной опухолью, показали, что у 94 % женщин было одностороннее поражение яичника, при этом у 28,6 % — отмечались признаки злокачественности опухоли [2]. Авторы исследования выделили 5 главных признаков, характерных для злокачественной опухоли:
- размер опухоли 7 см и более
- более чем 2 митоза в поле зрения при большом увеличении (×40)
- некрозы
- геморрагии
- 2–3 степень ядерной атипии

Окончательный диагноз стероидноклеточной опухоли основывается на данных гистологического исследования по наличию клеток полигональной формы с обильной цитоплазмой и отсутствию кристаллов Рейнке, а также положительной реакции по данным иммуногистохимии на ингибин и виментин (75 %), цитокератин (46 %) и панцитокератина АЕ1/АЕ3 (37 %) [1].
Основной метод лечения — резекция опухоли [10].
Заключение
Из-за редкой встречаемости сложно сказать, насколько эффективно назначение лучевой и химиотерапии при лечении стероидноклеточных опухолей. Относительно недавно несколько групп исследователей продемонстрировали, что аналоги гонадотропин-рилизинг гормона (ГнРГ) подавляют функцию яичников, снижают уровень половых гормонов в крови и индуцируют апоптоз опухолевых клеток [11, 12, 13]. Высказано предположение, что синтез андрогенов вирилизирующими опухолями яичников является гонадотропин-зависимым [11]. В этом случае функциональная активность различных андроген-секретирующих опухолей яичника не автономна, а находится под непрерывным влиянием гонадотропина. Исследователи из Японии выявили связь между рецепторами к ГнРГ и опухолевым ростом [12]. Сопряженность ГнРГ-рецептора с G-белками может быть также одним из механизмов, обеспечивающих антипролиферативное действие ГнРГ. Описанные терапевтические подходы применялись при рецидиве заболевания или в случае неоперабельной опухоли на уровне клинических испытаний.
Дальнейшие исследования, направленные на изучение природы и механизмов развития стероидноклеточной опухоли яичника, позволят обосновать методические рекомендации для врачей. Не исключено, что со временем это может заменить золотой стандарт лечения с хирургического удаления на консервативную тактику ведения таких пациентов.
4 февраля 2016
Текст: Тамара Тыринова (перевод)
Выпуск: №145, январь 2016 ВрачИсточник: jmedicalcasereports.com
4229 просмотров
4229 просмотров
Поделиться ссылкой с друзьями ВКонтакте Одноклассники
Нашли ошибку? Выделите текст и нажмите Ctrl+Enter.

 Катрен Стиль
Катрен Стиль.png)


зарегистрированным пользователям