Эпикардит, симулирующий опухолевый процесс
Пожилой мужчина был госпитализирован в стационар с жалобами на слабость и головокружение
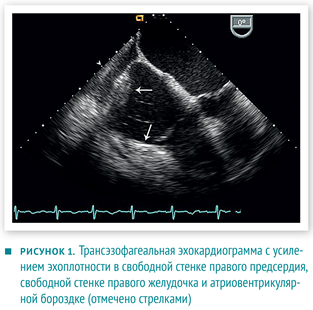
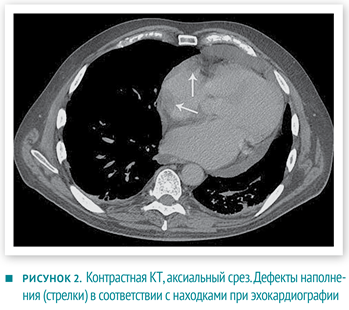
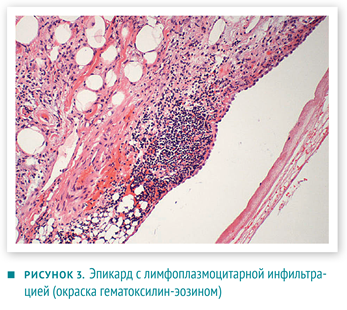
Дифференциальную диагностику проводили между первичной аденокарциномой с метастазами в сердце и двумя независимыми неопластическими процессами (в сердце и желудке).
- не было вовлечения париетального перикарда;
- заболевание протекало без констрикции сердечной мышцы;
- эпикардит выглядел как опухоль сердца;
- заболевание было ассоциировано с аденокарциномой.
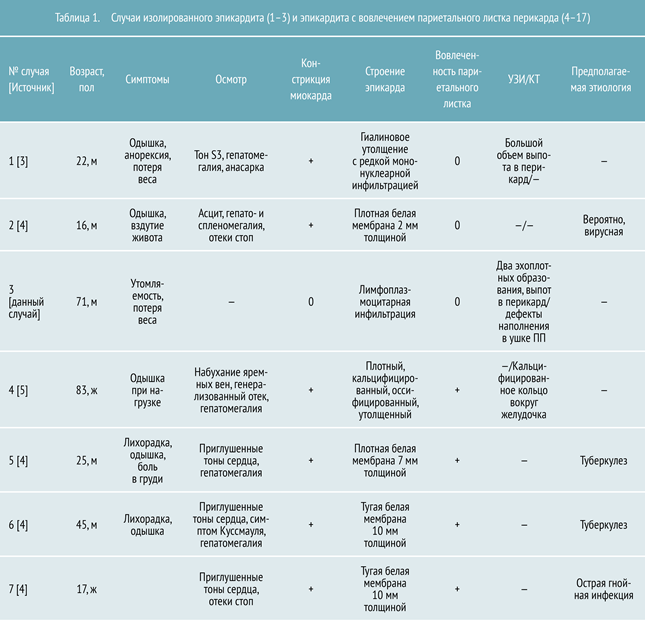
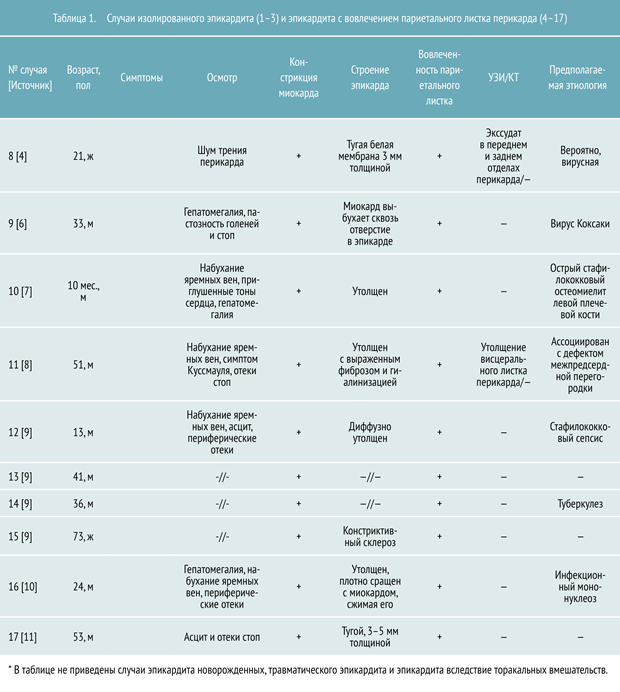
- оно может быть бессимптомным, без вовлечения париетального перикарда;
- заболевание может симулировать опухолевый процесс;
- его диагностика требует проведения биопсии;
- вероятна паранеопластическая природа возникновения эпикардита, что до сих пор не описано в литературе и должно стать предметом будущих исследований.
1.Burchell HB: Problems in the recognition and treatment of pericarditis. J Lancet 1954, 74 (12): 465–470.
2. Edwards JE: An atlas of acquired diseases of the heart and great vessels. Volume 1. London and Philadelphia: WB Saunders & Co; 1961: 436–441.
3. Dalvi BV, Bisne VV, Khandeparkar S: Localized epicarditis mimicking a cardiac tumor. Chest 1990, 98: 758–759.
4. Rasaretnam R, Chanmugam D: Subacute effusive constrictive epicarditis. Br Heart J 1980, 44: 44–48.
5. Ha JW, Chang BC, Choi BW, Chung N, Shin WH, Cho SY, Kim SS: Constrictive epicarditis as an unusual cause of constrictive physiology. Circulation 2005, 111: 365–366.
6. Cooper DK, Sturridge MF: Constrictive epicarditis following Coxsackie virus infection. Thorax 1976, 31: 472–474.
7. Castellanos A, Mercado H, Traggis DG, Altman DH: Successful surgical treatment of constrictive epicarditis in a ten-month-old infant: a case report. Acta Cardiol 1969, 24 (6):633–644.
8. Chou TM, Jue J, Merrick SH, Schiller NB, Foster E: Effusive constrictive epicarditis and atrial septal defect. AM Heart J 1993, 125: 1193–1195.
9. Walsh TJ, Baughman KL, Gardner TJ, Bulkley BH: Constrictive epicarditis as a cause of delayed or absent response to pericardiectomy. J Thorac Cardiovasc Surg 1982, 83 (1): 126–132.
10. Wilson DR, Lenkei SC, Paterson JF: Acute constrictive epicarditis following Infectious Mononucleosis; case report. Circulation 1961, 23:257–260.
11. Stolberg HO, Molnes RB: Constrictive epicarditis and hemopericardium. J Can Assoc Radiol 1962, 13: 86–94.
12. Algun E, Alici S, Topal C, Ugras S, Erkoc R, Sakarya ME, Ozbey N: Coexistence of subacute thyroiditis and renal cell carcinoma: a paraneoplastic syndrome. CMAJ 2003, 168: 985–986.
13. Dhungel S, Chalise SN, Kandel S, Shrestha B, Paudel B: Dysphagia as a presenting symptom in a case of dermatomyositis and occult gastric malignancy. Nepal Med Coll J 2005, 7: 77–80.
14. Meglic B, Graus F, Grad A: Anti-Yo-associated paraneoplastic cerebellar degeneration in a man with gastric adenocarcinoma. J Neurol Sci 2001, 185: 135–138.
15. Enomoto M, Takemura H, Suzuki M, Yuhara T, Akama T, Yamane K, Sumida T: Palmar fasciitis and polyarthritis associated with gastric carcinoma: complete resolution after total gastrectomy. Intern Med 2000, 39:685–686.
4326 просмотров
Поделиться ссылкой с друзьями ВКонтакте Одноклассники
Нашли ошибку? Выделите текст и нажмите Ctrl+Enter.

 Катрен Стиль
Катрен Стиль

зарегистрированным пользователям