
Измученный, но живой
Шесть лет борьбы за жизнь пациента с гепатоцеллюлярной карциномой
По материалам: Long-term survival in a patient with repeated resections for lung metastasis after hepatectomy for ruptured hepatocellular carcinoma: a case report
Shih K. L., Chen Y. Y., Teng T. H., Soon M. S.
Journal of Medical Case Reports 2008; 2:222.
Пятидесятилетний мужчина поступил в отделение гастроэнтерологии одной из больниц Тайваня с жалобами на усиливающиеся боли в животе в течение трех часов. Артериальное давление при поступлении составляло 88/58 мм рт. ст., частота сердечных сокращений — 109/мин. Большинство лабораторных показателей оставались в пределах нормы, отмечен низкий уровень гемоглобина — 8,8 г/дл (норма — 13,0–17,0 г/дл) и увеличение концентрации аланинаминотрансферазы — 145 Ед/л (норма <41 Ед/л).
Пациенту проведена трансфузия двух единиц эритроцитной массы и четырех единиц свежезамороженной плазмы, после чего показатели гемодинамики были стабилизированы: АД= 112/63 мм рт. ст., ЧСС= 75/мин.
При проведении компьютерной томографии (КТ) органов брюшной полости в 7‑м и 8‑м сегментах печени описано образование размерами 12×12,5×5 см (рис. 1) и скопление асцитической жидкости. При ангиографическом исследовании во всей правой доле печени выявлена обширная сеть неорганизованных расширенных извитых сосудов, питающих опухоль. Полученные данные свидетельствовали о наличии гепатоцеллюлярной карциномы (ГЦК) и возможном разрыве печени, требующем срочного оперативного вмешательства, однако, учитывая стабилизацию гемодинамики пациента, операция была отложена до более полного обследования. При дальнейшем лабораторном исследовании были выявлены маркеры вирусных гепатитов В и С (HBsAg, анти-HCV), уровень альфа-фетопротеина (αФП) — 20 нг/мл (норма < 10 нг/мл).
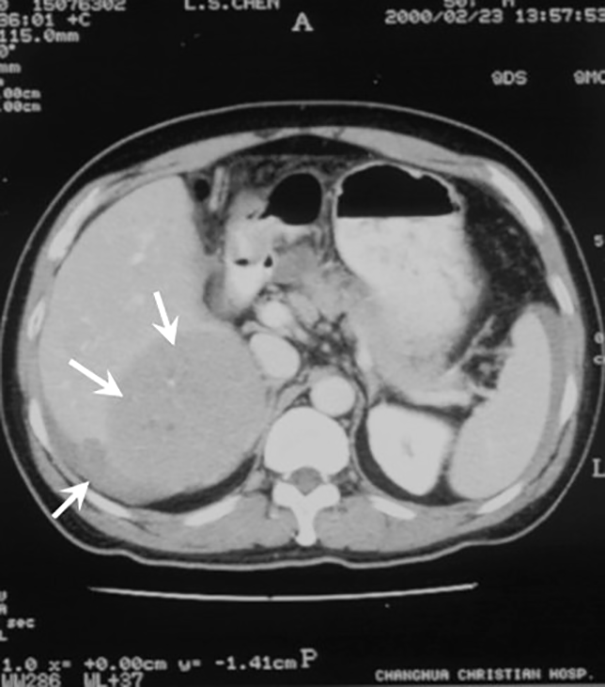
Рис. 1. Компьютерная томография органов брюшной полости. Объемное образование в 7-м и 8-м сегментах печени и жидкость в брюшной полости
Через три дня после поступления пациенту проведена правосторонняя расширенная гепатэктомия, частичная резекция прилегающего к опухоли участка диафрагмы (4×4 см), холецистэктомия. Эвакуировано 600 см3 кровянистой асцитической жидкости.
При гистологическом исследовании верифицирована низкодифференцированная ГЦК (рис. 2а), опухолевые клетки также обнаружены в резецированном участке диафрагмы.
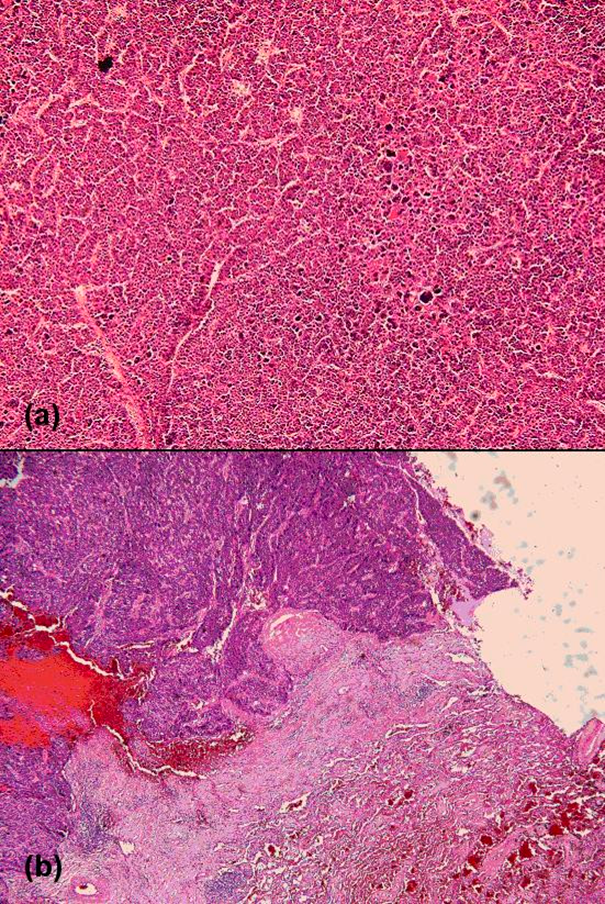
Рис. 2. Гистологическое исследование. А) Клетки неправильной формы с высоким ядерно-цитоплазматическим отношением, эозинофильной цитоплазмой со скоплениями гранул, округлыми ядрами с грубым хроматином; скопления гигантских клеток (исходное увеличение ×100). Б) Клетки метастатической ГЦК в паренхиме легкого (исходное увеличение ×40)
Послеоперационный период протекал без осложнений, пациент был выписан на 16‑й день после хирургического вмешательства. В дальнейшем каждые три месяца проводили оценку общего состояния, контроль уровня αФП, лучевое исследование органов грудной клетки и УЗИ органов брюшной полости. В динамике выявлено внутрипеченочное образование небольшого размера, расцененное как рецидив, по поводу которого дважды проведена чрескожная инъекция этанола под УЗ-контролем.
Через 30 мес. после хирургического вмешательства отмечено появление кровохарканья, при КТ-исследовании обнаружено образование в нижней доле правого легкого. Проведена клиновидная резекция. Размер опухоли составил 2×1×1 см, гистологически подтвержден метастаз ГЦК (рис. 2б).
В ходе дальнейшего наблюдения (через 52 мес. после резекции печени) при очередном КТ-исследовании обнаружен одиночный метастаз (d=2,9 см) в верхней доле правого легкого без признаков рецидива в печени. Проведена клиновидная резекция, также подтверждено метастазирование ГЦК.
Через 80 мес. после резекции печени при КТ грудной клетки выявлена опухоль в верхней доле правого легкого, прорастающая в плевру и подлежащие ткани (рис. 3). Уровень αФП составлял 39,14 нг/мл. Пациенту проведена комбинированная резекция верхней доли правого легкого и стенки грудной клетки с IV и V ребрами. Гистологическое исследование подтвердило метастатическую ГЦК. Через два мес. после операции уровень αФП снизился до 1,96 нг/мл.

Рис. 3. Компьютерная томография органов грудной клетки. Объемное образование, прорастающее в плевру и подлежащие ткани
Ко времени публикации у больного более пяти лет не было внутрипеченочных рецидивов ГЦК после чрескожных инъекций этанола, в течение 10 мес. от последнего вмешательства не обнаруживается признаков метастазирования в легкие и другие органы, а общая продолжительность жизни после резекции печени составляла 90 мес.
Обсуждение
ГЦК — наиболее частая первичная опухоль печени и одно из самых распространенных онкологических заболеваний. Спонтанный разрыв органа с развитием внутрибрюшного кровотечения — серьезное осложнение ГЦК, возникающее в 5–26 % случаев. Возможные механизмы: некроз опухоли, эрозия сосудов, тромбоз печеночных вен, в том числе опухолевыми массами, коагулопатия [1]. Летальность при развитии этого осложнения достигает 67 %, в особенности у больных с нарушениями функций печени [2–5]. Единственный метод лечения в этом случае — резекция печени [6]. Внутрибрюшные кровотечения при разрывах печени при ГЦК повышают риск диссеминации опухоли по брюшине.
Метастазы в легкие, наиболее частые при ГЦК, значительно ухудшают прогноз [7]. Часто развиваются множественные очаги метастазирования, что делает невозможным их хирургическое удаление [8]. В литературе описаны четыре критерия целесообразности легочной метастазэктомии: 1) низкая степень риска развития осложнений при хирургическом вмешательстве; 2) успешная терапия первичной опухоли; 3) отсутствие других — внелегочных — очагов метастазирования; 4) возможность полного удаления очагов в легких [9, 10]. В отдельных исследованиях описано увеличение выживаемости пациентов, которым проводилась резекция легочных метастазов [11–13].
В данной статье авторы описывают редкий случай значительного продления жизни пациента с ГЦК после разрыва печени, последующей резекции печени и трех резекций легочных метастазов. Авторы полагают, что данный подход — повторные резекции — может быть эффективен при рецидивирующих одиночных метастазах в легкие.
21 марта 2017
Текст: Автор перевода: Егор Баторов
Фото: www.istockphoto.com
Выпуск: №158, март 2017Источник: <a href="https://jmedicalcasereports.biomedcentral.com/articles/10.1186/1752‑1947‑2‑222">jmedicalcasereports.biomedcentral.com</a>
6947 просмотров
6947 просмотров
Поделиться ссылкой с друзьями ВКонтакте Одноклассники
Нашли ошибку? Выделите текст и нажмите Ctrl+Enter.

 Катрен Стиль
Катрен Стиль

зарегистрированным пользователям