Кома: туда и обратно
Автор перевода: Александра Варшал
По материалам: Elevated transaminases as a predictor of coma in a patient with anorexia nervosa: a case report and review of the literature Shuhei Yoshida, Masahiko Shimada, Miroslaw Kornek, Seong-Jun Kim, Katsunosuke Shimada and Detlef Schuppan Journal of Medical Case Reports 2010, 4:307
Источник:www.jmedicalcasereports.com
История болезни
В стационар в состоянии глубокой комы поступила японка 37 лет, оценка по шкале комы Глазго (ШКГ) – 3.
Шкала комы Глазго (ШКГ, The Glasgow Coma Scale, GCS) — шкала для оценки степени нарушения сознания и комы у детей старше четырех лет и взрослых. Шкала опубликована в 1974 году Грэхэмом Тиздейлом (Graham Teasdale) и Браен Дж. Джаннетт (Bryan J. Jennett), профессорами нейрохирургии Института Неврологических наук Университета Глазго.
Шкала состоит из трех тестов, оценивающих реакцию открывания глаз, речевые и двигательные реакции. За каждый тест начисляется определенное количество баллов. В тесте открывания глаз – от 1 до 4, в тесте речевых реакций – от 1 до 5, а в тесте на двигательные реакции – от 1 до 6 баллов. Таким образом, минимальное количество баллов — 3 (глубокая кома), максимальное — 15 (ясное сознание).
В анамнезе пациентки – нервная анорексия (НА) в течение12 лет, частые госпитализации в гастроэнтерологическое отделение для нутритивной поддержки. От госпитализации в психиатрический стационар пациентка отказывалась, отрицая наличие анорексии несмотря на то, что часто вызывала у себя рвоту. Она никогда не проходила психотерапию, не имела алкогольной, наркотической зависимостей, не пила антидепрессанты и не совершала суицидальные попытки. Три последних раза она была госпитализирована по поводу общего утомления в сочетании с острой печеночной недостаточностью. При госпитализациях оценка по ШКГ была в нормальном диапазоне: от 12 до 15. Каждый раз ей настоятельно рекомендовали получить консультацию психиатра, но она отвергала предложения. Таким образом, терапия состояла из назначения урсодезоксихолевой кислоты, мультивитаминов и энтеральных пищевых добавок.
При последних госпитализациях зафиксирована тяжелая дистрофия: она весила 29 кг при росте 152 см (ИМТ = 12,6). Температура тела была ниже 36 °C, АД около 85/50 мм рт. ст., ЧСС около 80 ударов в минуту.
При настоящей госпитализации: газовый состав артериальной крови в норме. На ЭКГ – синусовый ритм, ЧСС – 88 ударов в минуту. Реакция зрачков слабая, без мидриаза и миоза. Температура тела 35,6 °C. Никаких признаков легочно-сердечной патологии не было. Уровень сахара крови – 68 мг/дл (норма 70–160) при ее обычном сахаре 50–70 мг/дл. КТ и МРТ-ангиография головы аномалий не выявили. Печеночные ферменты были повышены: АСТ – 3194 МЕ/л (норма 7–38); АЛТ – 3540 МЕ/л (норма 4–44 ); ЩФ – 2388 МЕ/л (норма 100– 320 МЕ/л); ГГТП – 342 МЕ/л (норма 2–40). NH3 – 51 мкг/дл (норма 40–80). Отношение разветвленных аминокислот (branched-chain amino acids, ВCAА) к ароматическим аминокислотам (aromatic amino acids, AAA) было незначительно повышено – 3,8 при норме до 3,5.
Теория ложных нейротрансмиттеров
Разветвленные аминокислоты (валин, лейцин, изолейцин; сокр. ВСАА) и ароматические аминокислоты (фенилаланин, тирозин, триптофан; сокр. ААА) являются конкурентами в одной и той же транспортной системе гемато-энцефалического барьера. Поэтому при снижении концентрации ВСАА и повышении концентрации ААА (что имеет место при печеночной недостаточности) увеличивается поступление ААА в мозг, где из них синтезируются так называемые «ложные нейротрансмиттеры», например, октопамин, бета-фенилэтаноламин. Эти вещества стимулируют наступление печеночной комы. Из гипотезы вытекает терапевтическая тактика: выровнять дисбаланс аминокислот с помощью специальных растворов и затем начать лечение.
«Методические рекомендации. Парентеральное питание в интенсивной терапии и хирургии» (утв. Минздравсоцразвития РФ 29.08.2006 N 4630-РХ)
Альбумин – 3,6 г/дл (норма 3,8–5,3); общий билирубин – 1,7 мг/дл (норма 0,2–1,0); общий холестерин – 117 мг/дл (норма 130–220); активность протромбина – 49,8% (норма 80–120%); HbA1c, – 4.0% (норма 4,3–5,8%); азот мочевины крови – 23,6 мг/дл (норма 8,0–20,0), общий белок 5,0 г/дл (норма 6,5–8,2), тромбоциты – 12,7 × 104/мкл (норма 13–37 × 104/мкл). Лейкоциты, гемоглобин, гематокрит, креатинин, Fe, Zn, Cu – в норме.
Антинуклеарные и антимитохондриальные АТ – не выявлены. Серологические тесты на гепатотропные вирусы (гепатит А, В, С, цитомегаловирус и вирус Эпштейн-Барра) отрицательные. Анализ мочи на токсические вещества (алкоголь, марихуана, кокаин, парацетамол, амфетамины, бензодиазепины, метадон, опиаты) – отрицательный. Ультразвуковое исследование выявило жировую дистрофию печени средней степени. Показатели NH3 и BCAA/AAA оставались в норме во время и после комы, уровень глюкозы также был в пределах обычных для пациентки значений (таблица 1).
Таблица 1.
Лабораторные показатели при поступлении и во время госпитализации
|
| День 1 | День 2 | День 3 | День 4 | День 5 | День 7 | День 10 | День 14 | День 19 | День 25 | День 32 |
| АСТ (МЕ/л) (7-38) | 3194 | 4880 | 2556 | 1614 | 1567 | 1021 | 807 | 455 | 138 | 86 | 45 |
| АЛТ (МЕ/л) (4-44) | 3540 | 5408 | 4056 | 3672 | 2440 | 1958 | 1492 | 859 | 434 | 137 | 70 |
| ЩФ (МЕ/л) (100-320) | 2388 | 3282 | 2872 | 2732 | 1948 | 1649 | 1080 | 741 | 651 | 524 | 482 |
| Билирубин общ. (мг/дл) (0,2-1,0) | 1,7 | 2,3 | 2,7 | 2,2 | 2,5 | 2,1 | 2,0 | 1,4 | 1,5 | 1,2 | 0,9 |
| Альбумин (г/дл) (3,8-5,3) | 3,1 | 3,6 | 3,3 | 3,1 | 3,4 | 3,3 | 3,3 | 3,5 | 3,2 | 2,8 | 2,9 |
| NH3 (мкг/дл) (40-80) | 51 | 28 | 69 | 33 | 36 | 73 | 88 | 90 | 77 | 80 | 80 |
| Активность протромбина (%) (80-120) | 49,8 | 44,6 | 48,3 | 54,5 | 67,9 | 79,4 | |||||
| Сахар крови (мг/дл) (70-160) | 68 | 98 | 89 | 102 | 94 | 87 | 85 | 68 | 66 | 58 | 62 |
| BCAA/AAA (2,5-4,5) | 3,8 | 3,6 | 3,3 | 4,0 | 3,1 | 3,2 | |||||
| ШКГ (15) | 3 | 3 | 4 | 5 | 7 | 10 | 15 | 15 | 15 | 15 | 15 |
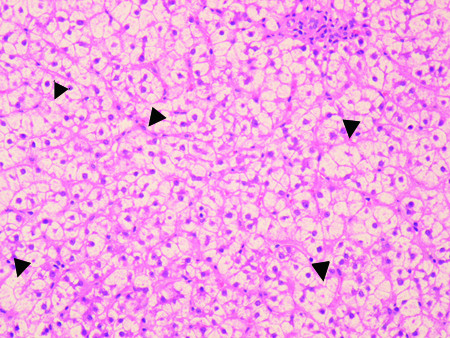 Рисунок 1. Препарат печени, окраска гематоксилин-эозином
Рисунок 1. Препарат печени, окраска гематоксилин-эозиномВ день поступления начато полное парентеральное питание и энтеральное питание через зонд. Сознание пациентки постепенно восстановилось к десятому дню, параллельно восстанавливалась нарушенная функция печени. Количество баллов по шкале Глазго имело обратную корреляцию с печеночными трансаминазами и не коррелировало с уровнем глюкозы крови, NH3 и отношением BCAA/AAA. На 14 день госпитализации, когда функция печени полностью восстановилась, была проведена биопсия органа. Найдены баллонная дистрофия гепатоцитов, некровоспалительные изменения и макровезикулярный стеатоз (рисунок 1), окрашивание на железо и медь дали отрицательный результат. Таким образом, единственная обнаруженная причина комы – острая печеночная недостаточность, вызванная нарушением питания.
Диффузный макровезикулярный стеатоз, многочисленные клетки с баллонной дистрофией. Некровоспалительные изменения представлены ацидофильными тельцами и фокусами некроза (отмечено стрелками)
Обсуждение
Нервная анорексия – это психосоматическое заболевание, плохо поддающееся лечению. Анорексия поражает в основном молодых женщин с превратным представлением о своем теле и непреодолимым желанием стать стройной. Легкое повреждение печени встречается почти в 40% случаях НА [1]. Описывают и острые тяжелые поражения печени у пациентов с НА, однако патогенез во многом остается неясным. Только в нескольких случаях описаны глубокие комы в основном гипогликемической этиологии у пациентов с анорексией [2-5]. Предположительно нарушение функции печени связано с недостаточностью белкового питания по типу дистрофии Квашиоркор с жировыми изменениями, однако до конца этот вопрос не выяснен [6].
В описываемом случае у пациентки быстро развилась глубокая кома, ассоциированная с острой печеночной недостаточностью. Состояние пациентки прогрессивно улучшалось с началом полного парентерального питания и энтерального питания с помощью назогастрального зонда. Насколько известно, это первый описанный в литературе случай печеночной комы на фоне анорексии.
Вызванные недоеданием аутофагия гепатоцитов [7] и оксидативный стресс гепатоцитов могут играть ведущую роль в нарушении функции печени при НА [8]. Выявленная баллонная дистрофия – это признак оксидативного стресса, апоптоза и аутофагии гепатоцитов при алкогольных и неалкогольных стеатозах [9]. Можно заключить, что истощение при НА усиливает оксидативный стресс, апоптоз и аутофагию гепатоцитов, что запускает острый гепатит с умеренным снижением печеночной функции. Однако патогенез комы в описанном случае отличается от развития классической печеночной энцефалопатии.
Интересно, что в описанном случае сознание возвращалось к пациентке одновременно со снижением уровня трансаминаз. Вероятно, острое поражение печени на фоне истощения привело и к повышению печеночных ферментов, и к развитию комы. Однако в литературе имеются данные о пациентах, которые находились в совершенно ясном сознании при высоких значениях трансаминаз [10].
Обращает на себя внимание тот факт, что у пациентки в отличие от больных с острой и хронической печеночной недостаточностью был нормальный уровень отношения BCAA/AAA и NH3 во время комы, хотя уровень аммиака обычно четко предсказывает развитие энцефалопатии при острой или хронической печеночной недостаточности [11]. Недавно было описано два случая, когда у пациентов с НА и нормальным уровнем трансаминаз развилась ятрогенная гипераммониемия, вызванная пищевыми добавками с высоким содержанием белка [11].
Заключение
Зачастую пациенты с НА и хроническим поражением печени имеют низкий уровень энцефалопатии, который не выявляется при рутинном исследовании. По этой причине необходимо регулярно проверять уровень трансаминаз у пациентов с НА, чтобы предупредить возможное развитие комы. Остается надеяться, что психиатрическое лечение пациентов с анорексией поможет избежать истощения и таких грозных осложнений, как кома.
Пациентка дала письменное согласие на публикацию своих случаев. Копия письменного согласия находится у главного редактора журнала (JOURNAL OF MEDICAL CASE REPORTS).
1. Mine T, Ogata E, Kumano H, Kuboki T, Suematsu H: Liver dysfunction in anorexia nervosa. Reports of the anorexia nervosa study group sponsored by The Japanese Ministry of Health and Welfare1991, 129-131 (in Japanese).
2. Yamada Y, Fushimi H, Inoue T, Nishinaka K, Kameyama M: Anorexia nervosa with recurrent hypoglycemic coma and cerebral hemorrhage. Intern Med 1996, 35: 560-563.
3. Nakai Y, Koh T: Perception of hunger to insulin-induced hypoglycemia in anorexia nervosa. Int J Eat Disord2001, 29: 354-357.
4. Bando N, Watanabe K, Tomotake M, Taniguchi T, Ohmori T: Central pontine myelinolysis associated with a hypoglycemic coma in anorexia nervosa. Gen Hosp Psychiatry 2005, 27: 372-374.
5. Rich LM, Caine MR, Findling JW, Shaker JL: Hypoglycemic coma in anorexia nervosa: case report and review of the literature.Arch Intern Med1990, 150: 894-895.
6. Sharp CW, Freeman CP: The medical complications of anorexia nervosa. Br J Psychiatry 1993, 162: 452-462.
7. Rautou PE, Cazals-Hatem D, Moreau R, Francoz C, Feldmann G, Lebrec D, Ogier-Denis E, Bedossa P, Valla D, Durand F: Acute liver cell damage in patients with anorexia nervosa: a possible role of starvation-induced hepatocyte autophagy. Gastroenterology 2008, 135: 840-848.
8. Tajiri K, Shimizu Y, Tsuneyama K, Sugiyama T: A case report of oxidative stress in a patient with anorexia nervosa. Int J Eat Disord 2006, 39: 616-618.
9. Tiniakos DG: Liver biopsy in alcoholic and non-alcoholic steatohepatitis patients. Gastroenterol Clin Biol2009, 33: 930-939.
10. Downan J, Arulraj R, Chesner I: Recurrent acute hepatic dysfunction in severe anorexia nervosa. Int J Eat Disord 2010.
11. Welsh E, Kucera J, Perloff MD: Iatrogenic hyperammonemia after anorexia. Arch Intern Med2010, 170: 486-488.
3823 просмотров
Поделиться ссылкой с друзьями ВКонтакте Одноклассники
Нашли ошибку? Выделите текст и нажмите Ctrl+Enter.

 Катрен Стиль
Катрен Стиль

зарегистрированным пользователям