
Медицинская ошибка: отравление углекислым газом и роковая горошина
Пожилого мужчину с одышкой госпитализировали в стационар — через месяц он скончался на фоне сердечной и дыхательной декомпенсации
По материалам: Carbon dioxide narcosis due to inappropriate oxygen delivery: a case report
Herren T., Achermann E., Hegi T., Reber A., Stäubli M.
Journal of Medical Case Reports 2017, 11:204
Семидесятидвухлетний мужчина обратился за медицинской помощью в связи с нарастанием одышки. Ранее при исследовании функции внешнего дыхания около 9 лет назад были выявлены признаки хронической обструктивной болезни легких (ХОБЛ) и эмфиземы: объем форсированного выдоха за первую секунду (ОФВ1) снижен до 38 % (норма — >80 %), проба с бронхолитиком отрицательная, общий объем легких и остаточный объем повышены. При осмотре бригадой скорой помощи — в сознании, возбужден. Объективно: ЧСС=103 уд/мин, АД=150/100 мм рт. ст., сатурация кислорода (SpO2) =81 % (норма 95–98 %). Пациенту была начата кислородная поддержка со скоростью 10 л/мин при помощи лицевой нереверсивной маски с резервным мешком (рис. 1). Через 20 минут SpO2 возросла до 99 %. Во время транспортировки в лечебное учреждение, на основании анамнеза пациента (длительное течение ХОБЛ), — медработники предположили «гипоксический» тип регуляции дыхательного центра. В этом случае интенсивная оксигенация могла бы привести к угнетению дыхательного центра. Госпитализирующая бригада приняла ошибочное решение о снижении скорости подачи О2 с 10 до 4 л/мин.
В норме парциальное давление CO2 в артериальной крови (РаCO2) влияет на активность дыхательного центра. Увеличение РаCO2 — гиперкапния — увеличивает частоту и глубину дыхательных движений.
При длительной хронической гиперкапнии, имеющей место при ХОБЛ, дыхательный центр перестает реагировать на концентрацию CO2 и начинает стимулироваться снижением концентрации O2 в крови (гипоксический тип регуляции). В этом случае при увеличении парциального давления O2 (РаO2), например, под действием оксигенотерапии, может снижаться активность дыхательного центра, угнетаться вентиляция и повышаться РаCO2 [1].
При поступлении в стационар пациент сначала был раздражительным, затем в течение короткого времени перестал ориентироваться во времени и месте, после чего потерял сознание. Объективно: рост 170 см, вес 50 кг, слизистые оболочки цианотичны, дыхание ослаблено, АД =110/80 мм рт. ст., ЧСС =80 уд/мин, выраженная гиперкапния с респираторным ацидозом (таблица 1А). Начата вентиляция мешком Амбу, затем пациент был незамедлительно интубирован для проведения ИВЛ. Также назначены ингаляции сальбутамола и ипратропиума бромида, внутривенное капельное введение метилпреднизолона, теофиллина, амоксициллина клавуланата и кларитромицина. Антибиотики даны в связи с локальным затемнением в правом легком, обнаруженном при обзорной рентгенографии органов грудной клетки.
Через четыре часа пациент был экстубирован (таблица 1В) и переведен из палаты интенсивной терапии в отделение. Кислородную поддержку осуществляли через носовой катетер со скоростью 2 л/мин. Высокое РаCO2 связали с низким дыхательным объемом легких и вероятным «гипоксическим» типом регуляции дыхательного центра (таблица 1С).
На четвертый день после поступления было отмечено нарастание одышки, в связи с чем начата оксигенотерапия лицевой маской с резервным мешком, однако, чтобы не подавлять работу дыхательного центра интенсивной оксигенотерапией (поскольку врачи полагали гипоксический тип регуляции), подачу O2 ошибочно проводили со скоростью всего 2 л/мин. Через несколько часов пациент был переведен в отделение интенсивной терапии с брадипноэ, гипотензией (АД=75/50 мм рт. ст.) и ухудшением показателей газов крови (таблица 1D). Проведена повторная интубация, ИВЛ в течение 24 часов норадреналином для поддержания частоты и силы сердечных сокращений. По данным ЭКГ: синусовый ритм, блокада правой ножки пучка Гиса, признаки гипертрофии правого желудочка. При ЭхоКГ выявлены признаки хронического легочного сердца и легочной гипертензии. После стабилизации состояния и положительной динамики по газовому составу крови пациент был экстубирован (таблица 1Е), однако аспирация горошины при приеме пищи и развитие ателектаза потребовали проведения бронхоскопии, трахеостомии и возобновления ИВЛ на десятый день госпитализации. Через месяц пациент скончался на фоне сердечной и дыхательной декомпенсации (таблица 1F). Аутопсию не проводили.
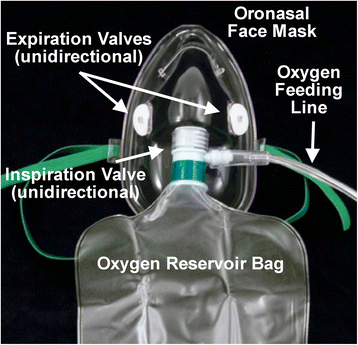
Рис. 1. Фотография лицевой нереверсивной маски с резервным кислородным мешком. Маска имеет один однонаправленный клапан вдоха и два однонаправленных клапана выдоха. Выдыхаемый CO2 постоянно разбавляется интенсивным потоком O2, нагнетаемым в маску (10–15 л/мин).
Нереверсивная маска покрывает как нос, так и рот пациента, удерживается с помощью эластичного шнура вокруг головы. К маске прикреплен резервуарный мешок, обычно объемом 1 литр, который соединен с внешним источником кислорода. Перед использованием мешок более чем на две трети заполняют кислородом. Приблизительно ¹/₃ воздуха из резервного мешка расходуется при вдохе пациента, и в мешок постоянно поступает O2 со скоростью 15 л/мин.
Система клапанов и достаточное уплотнение вокруг носа и рта позволяют доставлять пациенту высокие концентрации кислорода (60–80 %), в отличие от носового катетера, при использовании которого поступающий кислород сильно разбавляется воздухом окружающей среды. Выдыхаемый воздух выходит через односторонний клапан в маске. Это предотвращает вдыхание окружающего воздуха и повторное использование выдыхаемого воздуха.
Таблица 1. Анализ газов артериальной крови пациента на различных временных точках в течение пребывания в стационаре
| А, день 1 | В, день 1 | С, день 3 | D, день 4 | Е, день 5 | F, день 30 |
Скорость потока O2; метод оксигенотерапии | 4 л/мин; лицевая маска с резервным мешком | 2 л/мин; носовой катетер | 2 л/мин; носовой катетер | 4 л/мин; лицевая маска с резервным мешком | 2 л/мин; носовой катетер | 2 л/мин; трахеальная канюля |
р(Н) (7,3–7,4) | 7,1 | 7,3 | 7,4 | 7,2 | 7,4 | 7,1 |
PaO2 (kPa* [11,1–14,4]) | 10,9 | 10,4 | 6,8 | 6,0 | 8,1 | 10,9 |
PaCO2 (kPa* [4,7–6,4]) | 20,0 | 9,3 | 7,8 | 15,8 | 8,3 | 20,7 |
Бикарбонаты | 41,0 | 37,5 | 35,4 | 42,7 | 36,7 | 49,8 |
Избыток оснований (–1,5 – +3,0) | 3,0 | 8,2 | 9,1 | 9,4 | 10,5 | 17,7 |
SaO2 (% [95,0–99,9]) | 89,4 | 92,5 | 84,8 | 70,3 | 88,6 | 94 |
ЧД (/мин [12–16]) | ND | 30 | 24 | 0 | 30 | ND |
Примечания: O2 – кислород, PaO2 – парциальное давление кислорода в артериальной крови, PaСO2 – парциальное давление углекислого газа в артериальной крови, SaO2 – сатурация кислорода в артериальной крови, ЧД – частота дыхания. | ||||||
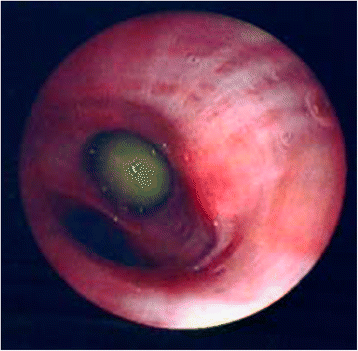
Рис. 2. Фотография, сделанная при бронхоскопии на 10‑й день госпитализации. Видна горошина в бронхе латерального базального сегмента правого легкого.
Обсуждение
ХОБЛ страдает около 12 % населения планеты [2]. Кислородная поддержка пациентов с обострением ХОБЛ остается сложной задачей. Следует с осторожностью подходить к подаче большого объема O2, так как у пациентов с ХОБЛ регуляция дыхательного центра может происходить по гипоксическому типу [3], т. е. оксигенотерапия будет угнетать дыхательный центр, а концентрация углекислого газа нарастать. Чтобы избежать отравления CO2, необходим контроль подачи O2 с целевыми показателями SpO2 = 88–92 % [4]. По данным исследования, включавшего 405 пациентов с обострением ХОБЛ, внутрибольничная смертность была значимо ниже (4 % против 9 %) при проведении кислородной поддержки на догоспитальном этапе через носовую канюлю по сравнению с подачей O2 при помощи лицевой нереверсивной маски с резервным мешком [5]. Также при подаче O2 через носовой катетер было меньше случаев ацидоза и гиперкапнии. Лицевые нереверсивные маски могут использоваться у пациентов с тяжелой гипоксией. При этом для обеспечения высокой концентрации вдыхаемого O2 необходимо устанавливать поток O2 со скоростью 10–15 л/мин. Из-за риска развития гиперкапнической дыхательной недостаточности необходим контроль газов крови каждые 30–60 мин.
Два описанных эпизода отравления CO2 (таблица 1А, D) были вызваны недостаточной подачей O2 (2–4 л/мин) через лицевую маску. Из опасения угнетения дыхательного центра на фоне гипотетически возможной его регуляции по гипоксическому типу, вместо необходимой скорости подачи O2 с контролем газов крови, поток был снижен до критически низкого.
В описанном случае, предполагая уменьшение дыхательного объема в связи с ХОБЛ до ≈200 мл (норма 7 мл/кг, для данного пациента — 350 мл) при частоте дыхания 30/мин (таблица 1В), минутный объем дыхания составлял около 6 л/мин (дыхательный объем × частота дыхания). В лицевой маске с резервным мешком только поток O2, превышающий минутный объем дыхания, гарантирует достаточную оксигенацию. Кроме того, недостаточное поступление O2 привело к увеличению концентрации CO2 и его повторному вдыханию.
Jensen с соавторами исследовали влияние различных скоростей подачи O2 через простую лицевую маску (без резервного мешка) на параметры внешнего дыхания и газообмен у десяти здоровых добровольцев. Снижение подачи O2 с 5 до 0 л/мин приводило к увеличению минутной вентиляции с 4,8 до 7,5 л/мин из‑за увеличения дыхательного объема с 380 до 540 мл практически без изменения частоты дыхания. PaO2 уменьшилось с 38 до 13 кПа, SaO2 — со 100 % до 96 %, при этом PaCO2 не изменилось. Авторы пришли к выводу, что у пациентов с ХОБЛ при использовании лицевой маски возможна задержка выведения CO2 при подаче O2 менее 5 л/мин, так как такие больные часто не способны увеличить дыхательный объем легких [6].
Заключение
Лицевые нереверсивные маски с резервным мешком должны использоваться с потоком O2, превышающим минутный объем дыхания пациента (> 6–10 л/мин.). В противном случае объема доставленного O2 будет недостаточно для эффективного насыщения артериальной крови. Также резко возрастает риск повторного вдыхания и отравления CO2, в особенности у пациентов с ХОБЛ. Лицевые маски с резервным мешком должны использоваться опытным медицинским персоналом при контроле газового состава крови для раннего выявления повышения РаCO2. Для пациентов с ХОБЛ безопаснее проведение кислородной поддержки с помощью носовой канюли со скоростью 1–2 л/мин, или простой лицевой маски со скоростью 5 л/мин.
Публикация клинического случая осуществлялась с согласия наследника пациента. Копия подписанного информированного согласия находится у главного редактора журнала Journal of medical case reports.
5 октября 2017
Текст: Автор перевода: Егор Баторов
Фото: www.istockphoto.com
Выпуск: №165, октябрь 2017Источник: <a href="https://jmedicalcasereports.biomedcentral.com/articles/10.1186/s13256-017-1363-7">https://jmedicalcasereports.biomedcentral.com/articles/10.1186/s13256-017-1363-7</a>
8236 просмотров
8236 просмотров
Поделиться ссылкой с друзьями ВКонтакте Одноклассники
Нашли ошибку? Выделите текст и нажмите Ctrl+Enter.

 Катрен Стиль
Катрен Стиль

зарегистрированным пользователям