Сложный выбор: терапия гепатитов В и С у пациента с пересаженной почкой
Гемодиализ, пересадка почки, 14 госпитализаций за 2 года и осторожная длительная терапия вирусных гепатитов
По материалам: Sustained eradication of hepatitis C virus by low-dose long-term interferon therapy in a renal transplant recipient with dual infection with hepatitis B and C viruses: a case report
Ming-Ling Chang, Ping-Chin Lai and Chau-Ting Yeh
Journal of Medical Case Reports20115:246
51‑летнему мужчине с терминальной стадией хронической почечной недостаточности, получавшему в течение 6 лет гемодиализ 3 раза в неделю, была проведена трансплантация почки. Еще на начальном этапе гемодиализа у него были выявлены поверхностные антигены вируса гепатита В (HBV), а через три года — антитела к вирусу гепатита С (HCV). В этот момент в крови: количество ДНК HBV — 4,1×106 копий/мл, количество РНК HCV — 5,9×105 копий/мл.
После трансплантации пациенту была назначена иммуносупрессивная терапия преднизолоном, микофенолата мофетилом, циклоспорином и такролимусом. В последующие два года после операции пациент 14 раз был госпитализирован в клинику по разным причинам, в том числе с цитомегаловирусной пневмонией, грибковой инфекцией мочевыводящих путей, лабиальным герпесом, острым кризом отторжения аллотрансплантата, туберкулезом легких, туберкулезным циститом, стриктурой уретры с обструктивной уропатией. Противотуберкулезную терапию проводили через год после трансплантации почки — в течение первых трех месяцев комбинацией препаратов изониазида, рифампицина и этамбутола, в фазе продолжения терапии еще на следующие семь месяцев был назначен изониазид.
Функциональные пробы печени (аланинаминотрансфераза (АЛТ), аспартатаминотрансфераза (АСТ), билирубин) в первый год после трансплантации были в норме, однако позже появилось умеренное повышение трансаминаз (1–3‑кратное). На этом фоне преднизолон отменили. Еще через год у пациента уровень трансаминаз превышал в 7 раз нормативные показатели, билирубин был 3–4 мг/дл (норма до 1 мг/дл), отмечалась желтуха. Количество ДНК HBV в сыворотке было ниже предела обнаружения (<300 копий/мл), тогда как РНК HCV генотипа 2а — 5,2×106 копий/мл (высокая вирусная нагрузка). Назначена монотерапия противовирусным препаратом рибавирином в дозе 200 мг/сут в первые 9 месяцев, а затем 200 мг через день в течение двух месяцев.
По завершении схемы лечения рибавирином выполнена биопсия печени, которая выявила у пациента хронический активный гепатит умеренной активности согласно индексу гистологической активности Knodell (перипортальный некроз — 3 балла из 10, внутридольковый некроз — 1 балл из 4, портальное воспаление — 3 балла из 4, фиброз — 3 балла из 4), а также жировой гепатоз. Кроме того, иммуногистохимически в биоптате печени обнаруживался HBs-антиген.
Пациенту назначен рибавирин повторно (200 мг/сут или через сут) и интерферон альфа-2b (3×106 ЕД подкожно 1–2 раза в неделю). Доза корригировалась с учетом состояния пациента и биохимических показателей его крови (рисунок 1) в течение 4 лет. Для профилактики реактивации HBV был назначен ламивудин (100 мг/сут), который пациент принимал в течение двух лет.
Рисунок 1.
Схема терапии пациента, перенесшего трансплантацию почки и инфицированного вирусом гепатита В и С
Обозначения:
вирусы гепатитов В и С — HBV и HCV соответственно;
1st yr~7th yr — с первого по седьмой год лечения;
серая линия и стрелки — количество РНК HCV (HCV RNA);
жирная линия и стрелки — количество ДНК HBV (HBV DNA);
красный отрезок — такролимус (tacrolimus);
зеленый отрезок — циклоспорин (tacrolimus);
черный отрезок — интерферон альфа 2b (interferon a-2b);
серый отрезок — рибавирин (ribavirin);
пустой отрезок — ламивудин (lamivudine)
В первые два года после описанного пика активности трансаминаз уровень АЛТ был в диапазоне 100–260 Ед/л, а затем постепенно стал снижаться. В конечной точке наблюдения активность АЛТ превышала норму не более чем в два раза. Состояние печени оценивалось как удовлетворительное: по данным эластометрии выявлялась только начальная стадия фиброза печени с умеренной жировой дистрофией. За год до окончания противовирусной терапии и уже после завершения курса, который в общей сложности длился почти 4 года, РНК HCV в сыворотке отсутствовала. Показатель количества ДНК HBV был ниже предела обнаружения еще на момент отмены преднизолона и в течение последующих шести лет наблюдения в крови пациента не выявлялся.
Обсуждение
Случаи коинфекции гепатита В (HBV) и гепатита С (HCV) представляют собой серьезную проблему в тех местах, где преобладает HBV. Прежде всего это касается Азиатского региона. Сочетанная инфекция HBV и HCV ускоряет прогрессирование поражения печени [3]. У пациентов, которым проводится трансплантация органов, из‑за необходимости назначения иммуносупрессивной терапии очень сложно контролировать состояние печени. При трансплантации печени пациентам с носительством HBV рекомендован длительный курс ламивудина для предупреждения реактивации инфекции [4]. Для реципиентов трансплантата почки подобная тактика в литературе не описана.
Сочетанное HBV- и HCV-инфицирование пациентов и взаимное влияние этих вирусов друг на друга наблюдалось ранее несколькими авторами [2, 3]. Так, описан случай снижения активности HBV при HCV-коинфекции у пациентов с трансплантированной почкой [3]. В приведенном клиническом случае изначально пациент был с высокой вирусной нагрузкой HBV (ДНК HBV до 4,1×106 копий/мл), но количество ДНК HBV стало ниже предела обнаружения на фоне активации HCV. Можно предположить, что подавление репликации HCV с помощью противовирусной терапии могло бы послужить триггером для реактивации HBV. В связи с этим было принято решение назначить пациенту ламивудин, который используется в лечении вируса гепатита В.
Несмотря на то что комбинированная терапия рибавирином и интерфероном — это стандарт лечения хронического HCV, общепринятой тактики, которая была бы эффективна в посттрансплантационном периоде до сих пор не разработано [1]. В описываемом клиническом случае биопсия печени, выполненная до начала противовирусной терапии, выявила наличие фиброза и признаки воспаления и некроза. При отсутствии должного лечения данное состояние могло трансформироваться в цирроз печени или привести к развитию гепатоцеллюлярной карциномы [5].
У пациента был диагностирован HCV генотипа 2а, который успешно лечится [6, 7]. Ранее были описаны случаи ведения HCV-больных с трансплантированной почкой. Режимы терапии были различны — монотерапия рибавирином, комбинированная терапия рибавирином и амантадином [7], интерферон в сочетании с рибавирином [2, 8], а также монотерапия препаратами интерферона [9]. Как оказалось, сочетание рибавирина и амантадина по эффективности не превосходило режим монотерапии рибавирином. Обе схемы лечения сопровождались нормализацией биохимических показателей, однако не снижали вирусную нагрузку у пациентов [2]. Ежедневные внутривенные инъекции препаратов интерферона бета в течение 6 недель приводили к снижению количества маркеров репликации HCV у реципиентов почки при условии хорошего функционального резерва трансплантированного органа [9].
Режим терапии низкими дозами интерферона альфа в комбинации с рибавирином может быть достаточно эффективным уже через полгода после начала лечения, но, к сожалению, плохо переносится большей частью пациентов и нередко приводит к дисфункциям трансплантата [2]. Схема лечения ультранизкими дозами интерферона альфа (1×106 ЕД подкожно 3 раза в неделю) и рибавирином (600 мг/сут) в течение 48 недель позволила добиться серонегативных результатов у 5 из 11 пациентов с HCV. Однако на фоне такой терапии у одного пациента развилось острое отторжение трансплантата и у двух пациентов — сепсис [8]. Как показывает опыт, комбинированная терапия интерфероном и рибавирином приводит к элиминации HCV-инфекции, однако дозы препаратов необходимо подбирать индивидуально для предупреждения реакции отторжения трансплантата. С другой стороны, недавно проведенные исследования свидетельствуют о том, что HCV-пациентам с устойчивой вирусной нагрузкой можно назначать длительный курс низких доз препаратов интерферона в качестве поддерживающей терапии, не забывая при этом о дополнительных мерах для поддержания почечной функции [10, 11].
За этот период не произошло реакции отторжения трансплантата, а также не было зафиксировано выраженных эпизодов присоединения каких‑либо инфекций. Важно отметить, что к концу терапии удалось подавить активность HCV, и до настоящего времени реактивации вируса не наблюдалось. Врачами был выбран препарат интерферона альфа, а не пегилированный интерферон, поскольку последний имеет более длительный период полувыведения и, следовательно, высока вероятность спровоцировать отторжение трансплантата. После окончания терапии у пациента уровень активности АЛТ оставался умеренно повышенным. Учитывая, что ДНК HBV и РНК HCV в сыворотке отсутствовали, высокий уровень трансаминаз был скорее связан с жировыми изменениями в печени пациента, а не с вирусом.
Заключение
Терапия низкими дозами препаратов интерферона может быть эффективной в лечении HCV у пациентов с коинфекцией HBV и HCV, перенесших трансплантацию почки.
Публикация клинического случая и сопутствующие иллюстрации осуществлялись с одобрения пациента. Копия подписанного информированного согласия находится у главного редактора журнала Journal of medical case reports.
15 апреля 2017
Текст: Автор перевода: Тамара Тыринова
Фото: www.istockphoto.com
Выпуск: №159, апрель 2017Источник: <a href="https://jmedicalcasereports.biomedcentral.com/articles/10.1186/1752-1947-5-246">jmedicalcasereports.biomedcentral.com</a>
4609 просмотров
4609 просмотров
Поделиться ссылкой с друзьями ВКонтакте Одноклассники
Нашли ошибку? Выделите текст и нажмите Ctrl+Enter.

 Катрен Стиль
Катрен Стиль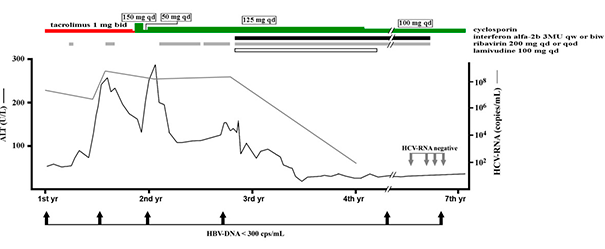

зарегистрированным пользователям