Если БАД — не БАД: как быть с бракованными товарами аптечного ассортимента?
Вторая часть обзора вебинара Ларисы Гарбузовой о работе аптечной организации с недоброкачественными медицинскими изделиями, БАД, парфюмерно-косметической продукцией и иными ТАА
Все, что приобретается в аптеке, должно быть качественным: и медицинская аппаратура, и минеральные воды, и лечебное питание… Вопросы проверки качества товаров аптечного ассортимента были подробно рассмотрены в ходе вебинара «Недоброкачественная продукция в аптеке: что делать?». Онлайн-лекцию, состоявшуюся в апреле на платформе КС, провела председатель правления Фармассоциации Санкт-Петербурга, доцент кафедры внутренних болезней, нефрологии, общей и клинической фармакологии с курсом фармации СЗГМУ им. И.И. Мечникова Лариса Гарбузова.
Детальный пересказ первой части трансляции, посвящённой работе аптечных организаций с недоброкачественными лекарственными препаратами, был опубликован ранее, а сегодня мы предлагаем вашему вниманию вторую часть обзора — о внутриаптечном контроле качества медицинских изделий и иных товаров аптечного ассортимента.
Продукция разная, принцип один
Несмотря на различие в характеристиках и функциях лекарств и других ТАА, процедура выявления недоброкачественной продукции в аптеке будет примерно одинакова:
- проверка госрегистрации на специальных информационных ресурсах, если товар подлежит обязательной регистрации;
- мониторинг писем профильного контролирующего органа об изъятии из обращения и о приостановлении обращения;
- осмотр товара;
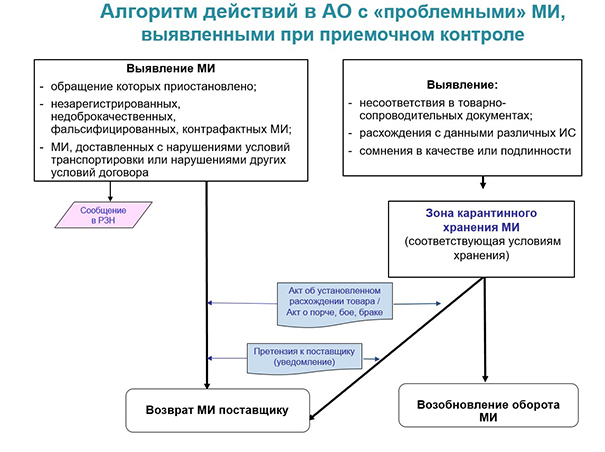
- при выявлении дефектов — помещение товара в карантинную зону;
- в зависимости от вида недостатков — утилизация, возврат поставщику или возобновление оборота.
Различия затрагивают скорее детали процесса. Например, для медицинских изделий сомнительного качества установлен специальный порядок изъятия и уничтожения, неприменимый для недоброкачественных лекарств, БАД и других категорий ассортимента, реализуемого в аптеке.
Будет ли исправна медицинская аппаратура? Проверяем на этапе приёмки
Медизделия, как и лекарства, регистрирует Росздравнадзор, поэтому с информацией об их качестве знакомиться нужно на сайте данной службы. Прежде всего, нужно проверить, зарегистрирована ли такая продукция. В этом фармацевтическому работнику поможет Госреестр медизделий и организаций (ИП), осуществляющих их производство и изготовление: www.roszdravnadzor.ru/services/misearch.
Будет полезен и Единый реестр медицинских изделий, зарегистрированных в рамках ЕАЭС, ведь целый ряд наименований, находящихся в обращении, оформлен уже не по национальным, а по евразийским правилам: https://med.eaeunion.org/med/registers/32/ru/register/registration-certificates.
Чтобы узнать о медизделиях, изъятых из обращения или «поставленных на паузу», нужно обратиться к интернет-ресурсу Росздравнадзора. Информационные письма о медицинских изделиях служба размещает на странице: https://www.roszdravnadzor.ru/services/unreg. И, разумеется, никто не отменял классическую процедуру приёмочного контроля, которая помогает выявить множество важных деталей.
Проверка «на входе» должна быть особенно тщательной. Нужно обратить внимание на несколько параметров:
- соответствие маркировки установленным требованиям. Здесь речь идёт не о кодах идентификации в системе мониторинга товародвижения (ГИС МТ), а об оформлении упаковки либо об информации, нанесённой на само изделие;
- внешний вид продукции;
- комплектность. Данный термин отвечает на простой вопрос: все ли необходимые детали на месте? Из-за производственного брака на склад и в аптеку может поступить, например, серия шприцев без инъекционных игл (при том, что упаковки этих изделий находятся в идеальном состоянии);
- документы, подтверждающие соответствие качества медизделий установленным нормам и правилам.
Для продукции, выпущенной в обращение с первого сентября 2022 г., понадобится декларация соответствия.
Когда код маркировки не в порядке
Многие виды медицинских изделий (как и технические средства реабилитации) подлежат учёту в системе МТ, и при их отпуске с первого марта нынешнего года на кассах действует разрешительный режим. Электроника не разрешит продажу маркированных медизделий, если:
- в системе «Честный знак» нет информации о коде маркировки на товаре;
- нет данных о нанесении кода маркировки на конкретную упаковку, а также о вводе этой упаковки в оборот;
- система сообщает, что товар с проверяемым кодом маркировки уже был выведен из обращения ранее;
- у продукции истёк срок годности;
- товар заблокирован по решению органа государственной власти (как это было сделано для БАД с симетиконом и мелатонином);
- код маркировки не отвечает характеристикам средства идентификации, например, наполовину стёрт и поэтому не читается.
Во всех названных случаях продукция также признаётся недоброкачественной, и её нужно передать на утилизацию либо вернуть поставщику. Данное правило распространяется и на остальные товары аптечного ассортимента.
По чьей инициативе могут быть изъяты медизделия?
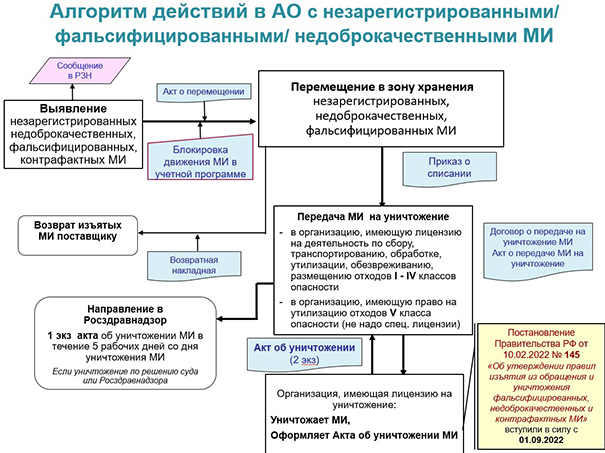
Согласно статье 38 ФЗ «Об основах охраны здоровья граждан в РФ», реализация фальсифицированных, недоброкачественных и контрафактных медизделий запрещена. Фальсификат и брак подлежит изъятию, а затем уничтожению или вывозу с территории нашей страны, контрафакт — изъятию и дальнейшему уничтожению. Порядок утилизации бракованных, поддельных и контрафактных медизделий определяется Правительством РФ.
Здесь напомним, что с 1 сентября 2022 г. действуют Правила изъятия и уничтожения фальсифицированных, недоброкачественных и контрафактных медицинских изделий, утверждённые постановлением Правительства РФ от 10.02.2022 № 145.
Согласно данным Правилам, контрафактные медизделия подлежат изъятию из обращения и уничтожению по решению суда. А вот фальсифицированную и бракованную продукцию можно изъять и утилизировать по нескольким различным основаниям:
- если так решил её владелец (например, аптечная организация);
- если так решил Росздравнадзор (или его территориальные органы);
- и опять же на основании судебного акта.
Когда сроки устанавливаются отдельно
Решение Росздравнадзора об изъятии и уничтожении медизделий публикуется на официальном сайте службы не позднее 3 рабочих дней со дня его принятия. В тексте документа обязательно должен быть указан срок изъятия из обращения и уничтожения фальсификата или бракованной продукции. Дело в том, что стандартные сроки для данной процедуры постановлением Правительства РФ от 10.02.2022 № 145 не определены.
По вердикту суда изымаются и утилизируются не только контрафактные медизделия. Если Росздравнадзор принял решение о выполнении этих действий с поддельной или некачественной продукцией, а владелец товара решение не исполнил (либо не сообщил о своём несогласии или не проинформировал о принятых мерах), сотрудники службы вправе обратиться в судебные органы. Тогда изъятие и уничтожение «некондиционных» предметов будет предписано уже судебным актом. В судебном постановлении должны быть указаны, в том числе, сроки выполнения процедуры.
Если медизделия сомнительного качества выявила аптека
Владелец медизделий, например, аптечная организация, тоже может принять решение об их изъятии и утилизации, но при одновременном соблюдении двух условий:
- если нет соответствующего решения Росздравнадзора или суда об изъятии и уничтожении медизделий;
- если есть подтверждение того факта, что медизделие является некачественным или фальсифицированным.
О принятом решении нужно будет уведомить производителя медизделий (или его уполномоченного представителя) и Росздравнадзор и дождаться их ответов и возражений.
Получив уведомление, компания-производитель не позже, чем в течение 30 рабочих дней, может направить мотивированное возражение на принятое решение владельцу медизделий и в Росздравнадзор. Это возражение владелец будет рассматривать тоже в течение 30 рабочих дней и затем направит производителю аргументированный ответ — или же сообщит об изменении решения и производителю, и контрольно-надзорному органу.
Право изъять и уничтожить некачественное либо поддельное медизделие появится у выявившей его аптеки не раньше, чем пройдёт 60 рабочих дней после отправки решения производителю и в Федеральную службу по надзору в сфере здравоохранения.
Внимание: для тех медизделий, у которых истёк срок годности, описанная процедура не требуется!
В случае с просроченной продукцией не нужно уведомлять ни производителя, ни Росздравнадзор. Можно сразу приступать к запланированным действиям.
Документация для процедуры утилизации
Напомним, что для списанных и переданных на уничтожение медизделий будет нужен ряд документов:
- приказ о списании товаров, подлежащих уничтожению (с копией);
- акт о списании (также с копией);
- выписка из реестра лицензий, подтверждающая право организации, проводившей утилизацию, на обезвреживание отходов I–IV класса опасности. К таким отходам могут относиться не только лекарства, но и некоторые другие ТАА;
- копия договора с организацией, проводившей утилизацию отходов;
- и акт об уничтожении товаров.
Такой же пакет документов понадобится для утилизации, например, просроченных или недоброкачественных БАД и других товаров аптечного ассортимента.
В течение пяти дней после того, как «некондиционные» медизделия были утилизированы, их владелец (аптечная организация) уведомляет об этом Росздравнадзор в форме электронного документа с приложением акта об уничтожении. Из этого правила нет исключений: проинформировать контролирующий орган нужно даже об утилизации просроченной продукции.
Возврат медизделий поставщику: как быть, если они маркированы?
Если в процессе приёмки у медизделий были выявлены недостатки, такую продукцию можно возвратить дистрибьютору. При этом важно учитывать требования ГИС МТ. Согласно постановлению Правительства РФ от 31.05.2023 № 894, обязательность поэкземплярного учёта медицинских изделий наступает с первого сентября текущего года, а до 31 августа разрешена добровольная передача кодов идентификации в универсальном передаточном документе (УПД), если контрагенты — например, аптека и дистрибьютор, — договорились об этом. Формат работы по спорным случаям определяется тоже по соглашению аптечной организации и поставщика и должен быть описан в договоре поставки.
После того, как собственником кодов идентификации, полученных в УПД, станет уже не дистрибьютор, а аптека, стандартный процесс возврата начнётся с оформления покупателем (аптечной организацией) претензии в форме ТОРГ-2 в адрес поставщика. В этом документе нужно будет привести обоснование необходимости возврата, например, вид недостатков (неисправность медицинского прибора, его некомплектность и т. д.). Получив претензию, поставщик согласует её и сформирует универсальный корректировочный документ (УКД) к тому УПД, по которому была произведена поставка.
Если исправить выявленные недочёты и восстановить надлежащее качество продукции невозможно, владелец кодов идентификации (а после оформления УКД эти коды возвращаются к продавцу, т. е. дистрибьютору) передаёт в ГИС МТ сведения о выводе из оборота. Он создаёт документ «Вывод из оборота» и обязательно отмечает причину данного действия: «Утилизация», «Уничтожение» или «Другое». При выборе варианта «Другое» нужно будет заполнить поле «Описание причины».
Вариант с обратной отправкой УПД в сторону продавца-фармдистрибьютора и видом товарооборота «Продажа» тоже возможен, но только в частных случаях и по согласованию обеих сторон.
Минводы и не только: как проверять биодобавки и прочие ТАА?
Отдельно стоит сказать о других видах нелекарственного ассортимента аптеки. Дезсредства, парфюмерно-косметическую продукцию, предметы и средства личной гигиены, предметы и средства для ухода за детьми младше трёх лет, минводы, лечебное, детское и диетическое питание, а также БАД регистрирует Роспотребнадзор. В ходе приёмки товаров аптечного ассортимента и ежедневного контроля их качества можно сверяться с данными этого контролирующего органа. Например, с государственным информационным ресурсом в сфере защиты прав потребителей (раздел «Сведения о фактах нарушения требований технических регламентов»): http://zpp.rospotrebnadzor.ru/badproducts/violations.
Полезен фармацевтическому работнику будет и раздел «Документы» на сайте службы: https://rospotrebnadzor.ru/documents/documents. php.
А вот сведения о госрегистрации товаров аптечного ассортимента можно проверить на интернет-страницах Реестра свидетельств о государственной регистрации Роспотребнадзора https://fp.crc.ru/evrazes/?type=max и Единого реестра свидетельств о госрегистрации ЕАЭС https://nsi.eaeunion.org/portal/1995? searchText=&date=2025‑05‑12
Алгоритм внутриаптечного контроля качества для «прочих» ТАА, не являющихся лекарствами и медизделиями, остаётся всё тем же:
- изучение информационных ресурсов по вопросам регистрации;
- ежедневный просмотр писем Роспотребнадзора о приостановлении, прекращении обращения или отзыве из обращения товаров аптечного ассортимента и проверка наличия таких наименований в аптеке;
- контроль сроков годности;
- внимательный осмотр продукции (включая, например, проверку целостности первичных и вторичных упаковок или чёткость маркировки);
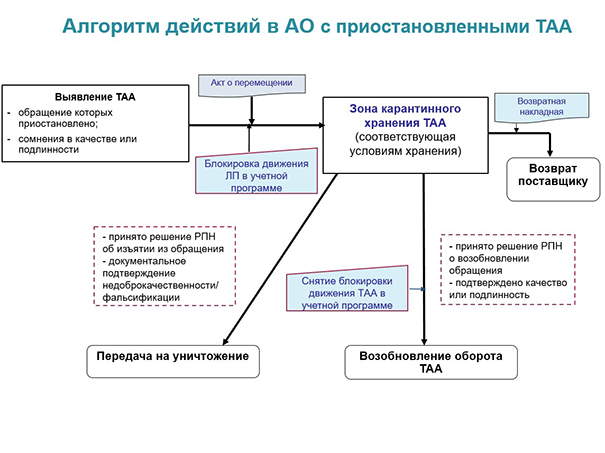
- помещение ТАА, подлежащих изъятию из обращения (согласно письмам контрольно-надзорного органа), просроченных и недоброкачественных (по итогам осмотра), а также тех, обращение которых приостановлено, в карантинную зону;
- в зависимости от выявленных недостатков — списание с передачей на уничтожение, возврат поставщику либо возобновление обращения (третий вариант возможен для «приостановленной» продукции).
Кроме того, на маркируемые товары аптечного ассортимента (те же биодобавки, кожные антисептики и лечебные воды) распространяются все те ограничения, которые действуют для прослеживаемых в системе мониторинга товародвижения медизделий. При нечитаемом коде маркировки и других перечисленных ранее затруднениях продукция подлежит списанию и утилизации.
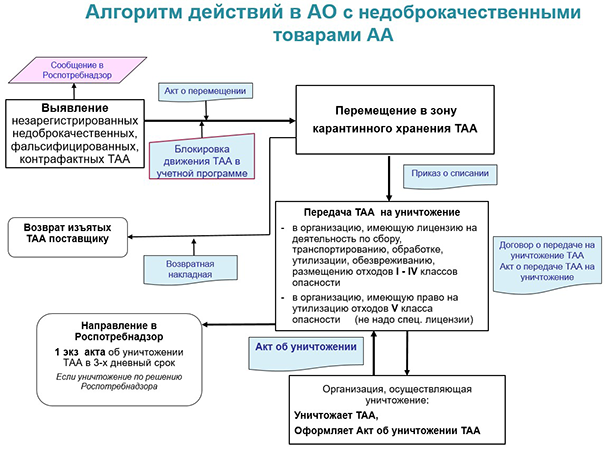
О чём говорят правовые акты
Вопреки распространённому мнению о «второстепенности» тех товаров аптечного ассортимента, которые не принадлежат к числу лекарств и медизделий, контроль над обращением тех же биодобавок и лечебного питания является не менее строгим. Пищевая продукция, не отвечающая требованиям технических регламентов и других нормативных документов (в том числе просроченная), подлежит:
- снятию с реализации;
- отзыву от потребителей;
- изъятию из обращения — либо по инициативе выявившей товар аптечной организации, либо по предписанию Роспотребнадзора;
- передаче на уничтожение.
Такие требования установлены статьями 5 и 18 Технического регламента Таможенного союза ТР ТС 021/2011 «О безопасности пищевой продукции», статьёй 20 ФЗ «О качестве и безопасности пищевых продуктов», пунктами 7.7 и 8.1 санитарно-эпидемиологических правил СП 2.3.6.3668–20, Положением о порядке изъятия из обращения, проведения экспертизы, временного хранения, утилизации или уничтожения некачественных и (или) опасных пищевых продуктов, материалов и изделий, контактирующих с пищевыми продуктами (утверждённым постановлением Правительства РФ от 07.10.2020 № 1612).
Согласно статьям 5 и 18 техрегламента «О безопасности пищевой продукции», изъятая пищевая продукция вплоть до утилизации должна храниться в условиях, исключающих возможность несанкционированного доступа к ней. При этом такая продукция подлежит учёту. Испорченные или подозрительные по качеству продукты питания нельзя хранить совместно с доброкачественными.
К качеству других товаров аптечного ассортимента действующая нормативно-правовая база также подходит внимательно. Например, согласно пункту 2 статьи 4 ТР ТС 009/2011 «О безопасности парфюмерно-косметической продукции», парфюмерно-косметическая продукция, не соответствующая требованиям данного техрегламента, не должна быть маркирована единым знаком обращения продукции на рынке государств-участников Таможенного союза и не может находиться в обороте. Аналогичные требования содержит и пункт 2 статьи 3 ТР ТС 007/2011 «О безопасности продукции, предназначенной для детей и подростков».
Карантин для нелекарственного ассортимента
Недоброкачественные, просроченные, изъятые из обращения товары аптечного ассортимента и такие ТАА, обращение которых приостановлено, должны храниться в специальной карантинной зоне — не вместе с лекарственными препаратами, а отдельно от них. Согласно пункту 66 Правил надлежащей аптечной практики, карантинная зона должна быть промаркирована, изолирована от зон хранения других товаров. Это может быть отдельный запирающийся шкаф — или отдельная полка в запирающемся шкафу. Все ТАА, находящиеся в карантинной зоне, должны быть идентифицированы и учтены.
Сотрудник, который по приказу руководителя аптечной организации работает с недоброкачественными товарами, несёт ответственность за их сохранность, учёт, оформление необходимых документов и передачу на уничтожение.
О выявлении сомнительных или просроченных товаров аптечного ассортимента аптечная организация должна сообщить в Роспотребнадзор. Будет необходима и процедура утилизации, особенности которой зависят от вида продукции (пакет документов для списания и передачи на уничтожение был подробно описан выше). Биодобавки или детское питание часто относятся к отходам V класса опасности (т. е. безопасным отходам), а вот косметика и дезсредства могут содержать опасные вещества.
При утилизации БАД, лечебного, детского и диетического питания следует руководствоваться Положением о порядке изъятия из обращения, проведения экспертизы, временного хранения, утилизации или уничтожения некачественных и (или) опасных пищевых продуктов.
Если передача ТАА на уничтожение была произведена по решению Роспотребнадзора, то копию акта об утилизации нужно предоставить контролирующему органу как можно скорее. Если же просроченный или бракованный товар был утилизирован по инициативе аптеки, службу уведомлять не надо, но копию акта об уничтожении продукции следует продолжать хранить.
Алгоритмы мониторинга: возврат и вывод из оборота
В настоящее время, наряду с лекарствами, медизделиями и техническими средствами реабилитации, маркировке подлежат БАД, питьевая вода, кожные антисептики — дезсредства для обработки рук, дезсредства для обработки поверхностей, парфюмерия и косметика для гигиены рук с антимикробным действием. Постепенно в сферу мониторинга товародвижения погружаются и другие категории нелекарственного ассортимента аптеки. Например, с первого мая началась маркировка мыла.
Поэтому, как и при возврате медицинских изделий, для возврата других маркированных ТАА поставщик должен сформировать универсальный корректировочный документ (УКД) к тому УПД, по которому была выполнена поставка бракованной продукции. Ещё один способ возврата товара — формирование поставщиком УПД (и) с видом товарооборота «8 — Возврат товара от Покупателя Продавцу» / «00009 — Возврат товара от Покупателя Продавцу».
Если же недоброкачественный ТАА направляется на утилизацию, будет необходимо сформировать в системе МТ документ «Вывод из оборота», отметив одно из оснований: «Уничтожение», «Утилизация», «Истечение срока годности» либо «Другое». Для варианта «Другое», как и в случае с медизделиями, нужно заполнить поле «Описание причины».
Дополнительно сообщается, что участник обращения товаров аптечного ассортимента самостоятельно принимает решение о дальнейших действиях с бракованной продукцией.
Dura lex, sed lex: ещё раз о юридической ответственности
Допуск фальсификата, контрафакта и некачественных товаров в обращение — серьёзное нарушение законодательства. За реализацию фальсифицированных, контрафактных, недоброкачественных и незарегистрированных лекарств и медизделий, а также фальсифицированных биодобавок, согласно статье 6.33 КоАП, для юрлиц предусмотрены штрафы в размере от 1 до 5 миллионов рублей.
Сбыт фальсифицированных, контрафактных, недоброкачественных и незарегистрированных лекарств и медизделий, а также фальсифицированных БАД стоимостью свыше ста тысяч рублей является уже уголовно наказуемым деянием. Такие действия подлежат ответственности по статье 238.1 УК РФ «Обращение фальсифицированных, недоброкачественных и незарегистрированных лекарственных средств, медицинских изделий и оборот фальсифицированных биологически активных добавок».
Нарушение исполнителем, продавцом требований техрегламентов (или обязательных требований, подлежащих применению до дня вступления в силу соответствующих техрегламентов) к продукции, а также к процессам её использования, хранения, перевозки, реализации и утилизации предусматривает ответственность по статье 14.43 КоАП. Для юридических лиц это административные штрафы от ста до трехсот тысяч рублей.
Невыполнение продавцом обязанности по приостановлению реализации продукции, не соответствующей требованиям техрегламентов (или подлежащим применению до дня вступления в силу таких документов обязательным требованиям к продукции), либо по отзыву такой продукции является административным правонарушением в силу статьи 14.46.2 КоАП. Штрафы для юридических лиц в данном случае могут составлять от ста до пятисот тысяч рублей.
Редакция КС напоминает, что мы ежемесячно публикуем обзоры лишённых регистрации и отозванных ЛП в рубрике «У вас проверка!».
26 июня 2025
Текст: Екатерина Алтайская
Фото: www.istockphoto.com/alfexe
Выпуск: №258, июнь 2025267 просмотров
267 просмотров
Поделиться ссылкой с друзьями ВКонтакте Одноклассники
Нашли ошибку? Выделите текст и нажмите Ctrl+Enter.

 Катрен Стиль
Катрен Стиль


зарегистрированным пользователям