От всего сердца
Ольга Сартакова об истории развития трансплантации сердца
В Российской Федерации 7 % взрослых людей страдают хронической сердечной недостаточностью (ХСН). Ежегодно, даже в условиях лечения в специализированном стационаре, умирает до 12 % больных с клинически выраженной ХСН. Единственное, что может помочь пациенту в терминальной стадии этого заболевания, — трансплантация сердца.
Не все нуждающиеся в операции доживают до ее проведения, но с тех пор как 46 лет назад бригада доктора Кристиана Барнарда провела первую в мире пересадку сердца от человека к человеку, у них по крайней мере появилась надежда на выздоровление.
История вопроса
Успехи трансплантологии связаны с развитием двух независимых сфер медицины: совершенствованием хирургической техники и методов анестезии с одной стороны, и достижениями иммунологии и фармакологии — с другой. Первое обеспечило удачное проведение операций, а второе — благополучное протекание послеоперационного периода.
Первые шаги
Еще в XVI веке итальянский хирург Гаспаро Тальякоцци после ряда неудачных экспериментов с пересадкой кожи от человека к человеку представил публике успешный результат аутотрансплантации (пересадки собственного органа реципиента, в данном случае — кожи). В 1596 году он описал свои наблюдения «силы и мощи индивидуальности» в труде «De Curtorum Chirurgia per Insitionem» (Замещающая хирургия с использованием пересадки).
Однако широкий интерес идея трансплантации органов вызвала лишь спустя 300 лет, когда хирурги массово приступили к практическим опытам. Вновь столкнувшись с проблемой отторжения, они обогатили медицину тремя важными выводами: межвидовые пересадки органов (ксенотрансплантации) всегда неуспешны; пересадки между представителями одного вида (аллогенетические трансплантации) в большинстве случаев тоже, причем повторные пересадки органов между одними и теми же донорами и реципиентами ускоряли отторжение; если между донором и реципиентом было кровное родство, вероятность благоприятного исхода операции значительно увеличивалась, причем пересадка собственных органов (аутотрансплантация) почти всегда были удачна.
Первая описанная в литературе успешная трансплантация датируется II веком нашей эры: индийский хирург Шушрата произвел пересадку кожи в ходе ринопластики.
А в III веке, если верить хроникам римской католической церкви, святые Дамиан и Косма пересадили потерявшему ногу от гангрены римскому дьякону Юстиниану конечность недавно умершего эфиопа.
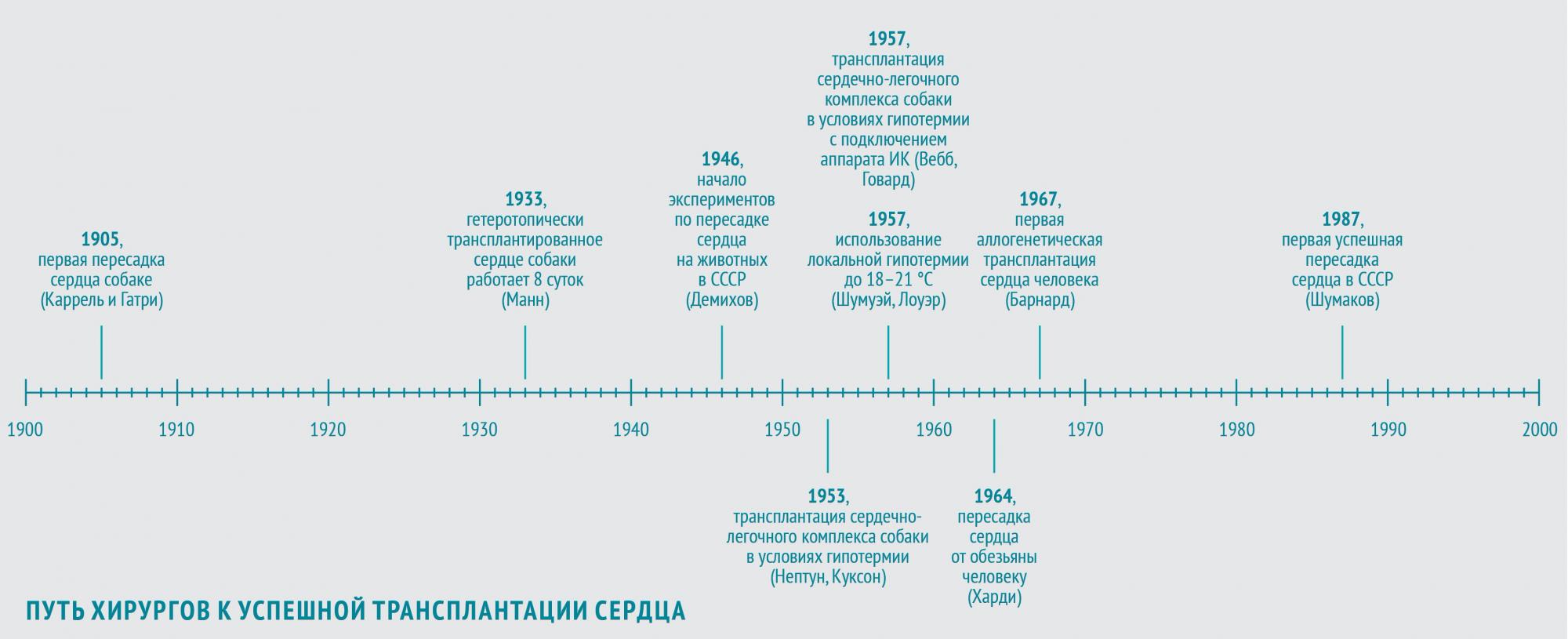
Собачье сердце
В 1905 году в череде опытов по пересадке органов очередь дошла и до сердца. Первую трансплантацию сердца собаки-донора на сосуды шеи собаки-реципиента осуществили хирург, биолог и патофизиолог Алексис Каррель и физиолог Шарль Гатри, американцы французского происхождения. Донорское сердце проработало 2 часа.
В 1933 году американский физиолог Фрэнк Манн с коллегами повторил опыт Карреля и показал возможность функционирования гетеротопически (то есть размещенного в нетипичном месте) трансплантированного сердца собаки вплоть до 8 суток (собственное сердце собаки оставалось на месте и продолжало работать).
В ногу со временем шли и советские хирурги. Наиболее весомый вклад в экспериментальные основы трансплантации сердца в СССР внес Владимир Петрович Демихов. С 1946 по 1955 год он в нескольких сотнях экспериментов разработал 24 (!) варианта хирургической техники гетеротопической трансплантации сердца в грудную клетку. В некоторых опытах донорское сердце эффективно обеспечивало кровообращение собаки-реципиента в течение более чем 15 часов.
Борьба с ишемией
Самой явной проблемой, вставшей на пути хирургов, стала ишемия: в условиях недостаточного кровотока повреждались и ткани реципиента, и донорские сердца. Трансплантацию невозможно провести в сжатые сроки, поэтому хирурги и анестезиологи стали искать способы, позволяющие продлить время операции. Так были разработаны методы управляемой гипотермии и спроектированы аппараты искусственного кровообращения (ИК).
Управляемая гипотермия позволяет снизить кровопотерю, а также продлить время операции без повышения риска ишемизации тканей.
В 1953 году американские хирурги Уилфорд Нептун и Брайан Куксон с коллегами выполнили первую трансплантацию сердечно-легочного комплекса собаки в условиях глубокой гипотермии (во время операции в комнате поддерживалась температура порядка минус 4 °С).
В 1957 году американцы Уильям Вебб и Хизер Говард повторили этот эксперимент, подключив собаку-реципиента к аппарату ИК. Позднее они сообщили о пересадке в тех же условиях изолированного сердца. Они накладывали девять анастомозов между аортой, легочной артерией, легочной и полой венами. Правда, этот трансплантат профункционировал всего 7 часов.
К середине 60-х Норман Шумуэй и Ричард Лоуэр с коллегами из клиники при Стэнфордском университете разработали методику трансплантации сердца, которая используется по сей день: с использованием «локальной гипотермии» — местного охлаждения до 18–21 °С. С этого момента для успешного проведения операции осталось только одно препятствие — иммунологическое отторжение.
Причины отторжения
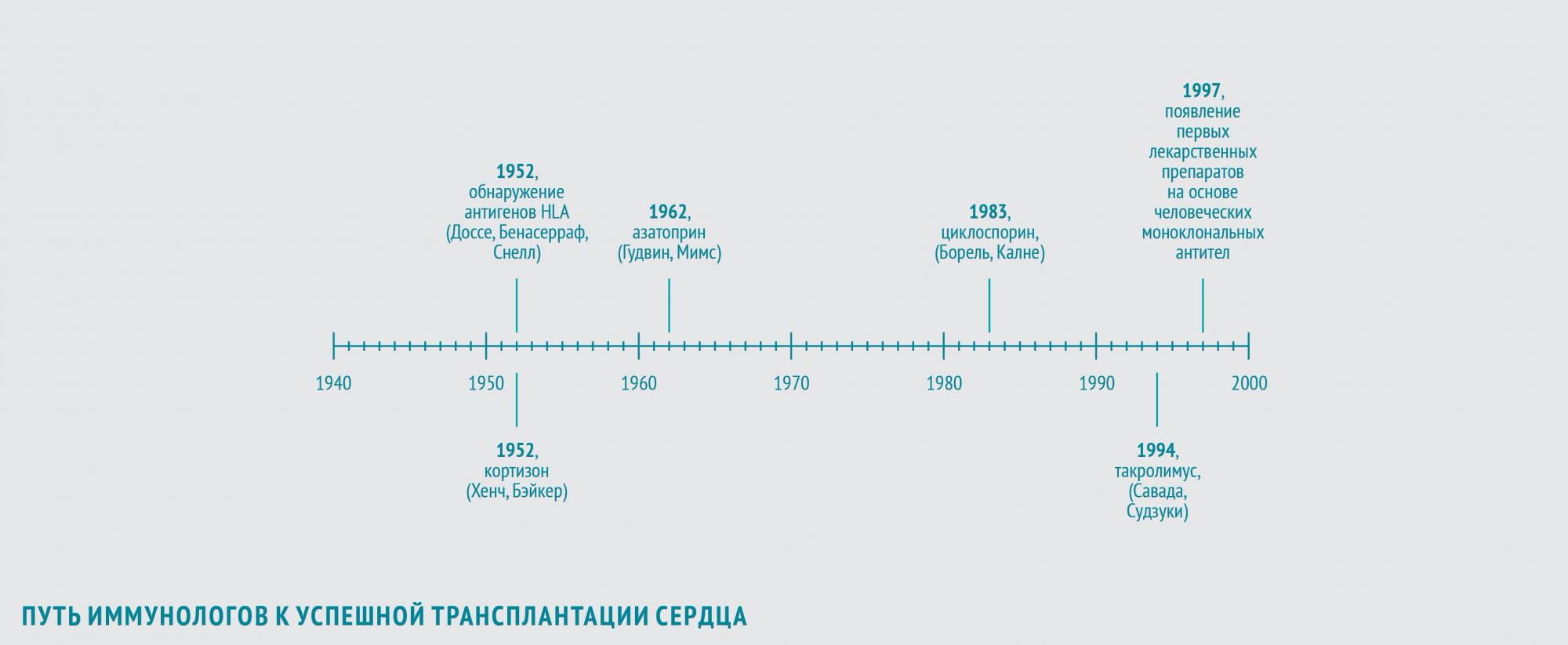
В 1952 году иммунологи Жан Доссе (Франция) и Барух Бенасерраф (США) вместе с генетиком Джорджем Снеллом (США) обнаружили, что важнейшие антигены, участвующие в отторжении трансплантата, – антигены главного комплекса гистосовместимости (HLA). За это открытие в 1980 году они были удостоены Нобелевской премии.
Существует порядка 150 вариантов антигенов HLA, и у каждого человека на мембранах клеток присутствует по шесть вариантов таких антигенов. Следовательно, возможно более триллиона их комбинаций – вероятность существования двух людей с одинаковыми комплексами HLA-антигенов близка к нулю, конечно, если они не однояйцевые близнецы. Идеально, если у донора и реципиента наблюдается несовпадение лишь одного антигена из шести. Операции проводят и в том случае, если не совпадают два, однако при этом увеличивается риск развития иммунологического отторжения.
На практике определение совместимости тканей — гистотипирование — осуществляется по лимфоцитам крови.
Со стороны «хозяина» основные эффекторы трансплантационного отторжения – это цитотоксические CD8 T-клетки и CD4 Т-клетки. Последние привлекают в зону отторжения трансплантата клетки воспаления (в том числе макрофаги). Распознание трансплантационных антигенов происходит либо непосредственно на клетках трансплантата, либо в ближайшей лимфоидной ткани.
Немалую роль в отторжении трансплантата могут сыграть и антитела в организме реципиента (например, появившиеся из-за предшествующего переливания цельной крови). Взаимодействуя с антигенами эндотелия сосудов, пронизывающих трансплантат, они инициируют систему комплемента и каскад реакций, приводящий к закупорке сосудов.
Иммуносупрессия
Первыми веществами, которые начали использовать для подавления иммунного ответа, стали кортикостероиды.
В 1948 году американский врач Филип Хенч, применив кортизон в лечении ревматоидного артрита, показал, что препарат обладает выраженным противовоспалительным действием. В 1952 году американский хирург Роджер Бэйкер с коллегами продемонстрировал, что кортизон может использоваться и для иммуносупрессии после трансплантации.
В 1962 году американцы Уиллард Гудвин и Мэтт Мимс впервые использовали азатиоприн — иммуносупрессивный препарат, обладающий наибольшей активностью в отношении Т-лимфоцитов, для предотвращения острого отторжения трансплантированной почки. Пациентам с пересаженным сердцем также планировалось назначать азатиоприн в сочетании с кортикостероидами.
Очередь человека
Человеку сердце было впервые пересажено в 1964 году. Джеймс Харди с коллегами трансплантировали сердце крупного шимпанзе, весившего более 43 кг, больному 68 лет с тяжелой формой ИБС в терминальной стадии прогрессирующей сердечной недостаточности. Вначале трансплантат работал удовлетворительно, однако через час после отключения аппарата ИК развилась острая сердечная недостаточность, обусловленная объемной перегрузкой трансплантата, и больной погиб.
Первая аллогенетическая трансплантация сердца человеку была проведена три года спустя в Кейптауне южноафриканским хирургом Кристианом Барнардом, прошедшим стажировку под руководством Нормана Шумуэя. Бригада доктора Барнарда пересадила сердце 25-летней девушки, погибшей в автомобильной аварии, 55-летнему диабетику, перенесшему три инфаркта и страдавшему от застойной сердечной недостаточности. Трансплантация прошла удачно, но на 18-е сутки после операции пациент умер от двусторонней пневмонии. Через месяц в этой же клинике была выполнена вторая трансплантация донорского сердца, после которой реципиент прожил полтора года, умерев от хронического отторжения.
В СССР первая успешная трансплантация сердца была осуществлена в 1987 году знаменитым врачом-трансплантологом академиком АМН СССР Валерием Ивановичем Шумаковым (1931–2008).
Успех первого клинического опыта увлек медицинское сообщество, и к решению задачи трансплантации сердца обратились хирурги всего мира. Однако большинство пациентов умирало вскоре после проведения операции, и интерес исследователей начал угасать: если в 1968 году было проведено 100 трансплантаций сердца, то в 1970 — всего 18. Главной причиной смерти оставалось отторжение пересаженных органов.
Лишь четверо из прооперированных в период с 1967 по 1973 год прожили с новым сердцем дольше года; с 1974 по 1983 год годичная выживаемость увеличилась до 60 %, а вот пятилетняя составила лишь 21 %.
Иммунологи и фармакологи берутся за дело
В 1983 году увенчались успехом клинические исследования нового иммуносупрессора — циклоспорина, нерибосомного полипептида, получаемого из почвенных грибов вида Beauveria nivea. Его выделили в 1970 году в рамках программы по скринингу новых антибиотиков. В 1972 году бельгийский иммунолог Жан-Франсуа Борель открыл способность циклоспорина ингибировать культуру лимфоцитов при отсутствии общего цитостатического эффекта. В конце 70-х британский хирург Рой Калне провел первые испытания эффективности циклоспорина после трансплантации сердца и почек на экспериментальных животных. Его внедрение в широкую практику открыло новую эру в трансплантации сердца, поскольку позволило значительно продлить жизнь пациентов после трансплантации. В 1994 году было одобрено использование для послеоперационной терапии еще одного нового иммуносупрессора — такролимуса (FK-506) из группы макролидов, продуцируемого актиномицетом Streptomyces tsukubaensis. В 1987 году японские иммунологи Шиничи Савада и Джен Судзуки в экспериментах in vitro обнаружили, что такролимус в 100 раз активнее циклоспорина подавляет пролиферацию Т-лимфоцитов. В исследованиях на крысах, собаках и приматах, проводившихся с 1988 по 1993 год, такролимус обеспечивал профилактику отторжения трансплантата в дозах в 10–100 раз более низких, чем циклоспорин, и с меньшим количеством побочных эффектов. Впрочем, модификации циклоспорина, разработанные в то же время, обладали аналогичными преимуществами.
Последние успехи иммуносупрессии связаны с поли- и моноклональными антителами (подробно об этом мы рассказывали в КС № 5 (118) 2013, статья «Достижения фармацевтики: моноклональные антитела»), позволяющими предотвратить стероид-резистентное — не купируемое даже пульс-терапией метилпреднизолоном — отторжение тканей, которое встречается с частотой 10–18 %.
В настоящее время используется трехкомпонентная схема иммуносупрессивной терапии: циклоспорин А или такролимус в сочетании с метилпреднизолоном и микофенолата мофетилом (цитостатиком, который наиболее эффективен в отношении лимфоцитов). Препараты антилимфоцитарных антител (ALG, ATG, ОКТ-3) применяются в качестве вводной терапии, а также при выраженных признаках отторжения или стероид-резистентном отторжении.
Современная статистика
На сегодняшний день в мире проведено уже более 15000 трансплантаций сердца. 10-летняя выживаемость пациентов составляет около 50 %. Самая большая летальность — в первый год после операции (в разных клиниках – от 15 до 25 %). Основные причины смерти — инфекционные заболевания и саркома Капоши, развивающиеся на фоне иммуносупрессивной терапии.
Описаны и счастливые случаи, когда пациенты с трансплантированным сердцем прожили более 25 лет. Мировым рекордсменом стал Тони Хьюзман — пациент клиники при Стэнфордском университете. Его прооперировали в 1978 году, показанием послужила дилатационная кардиомиопатия. После трансплантации он прожил 30 лет и умер в 51 год от рака кожи.
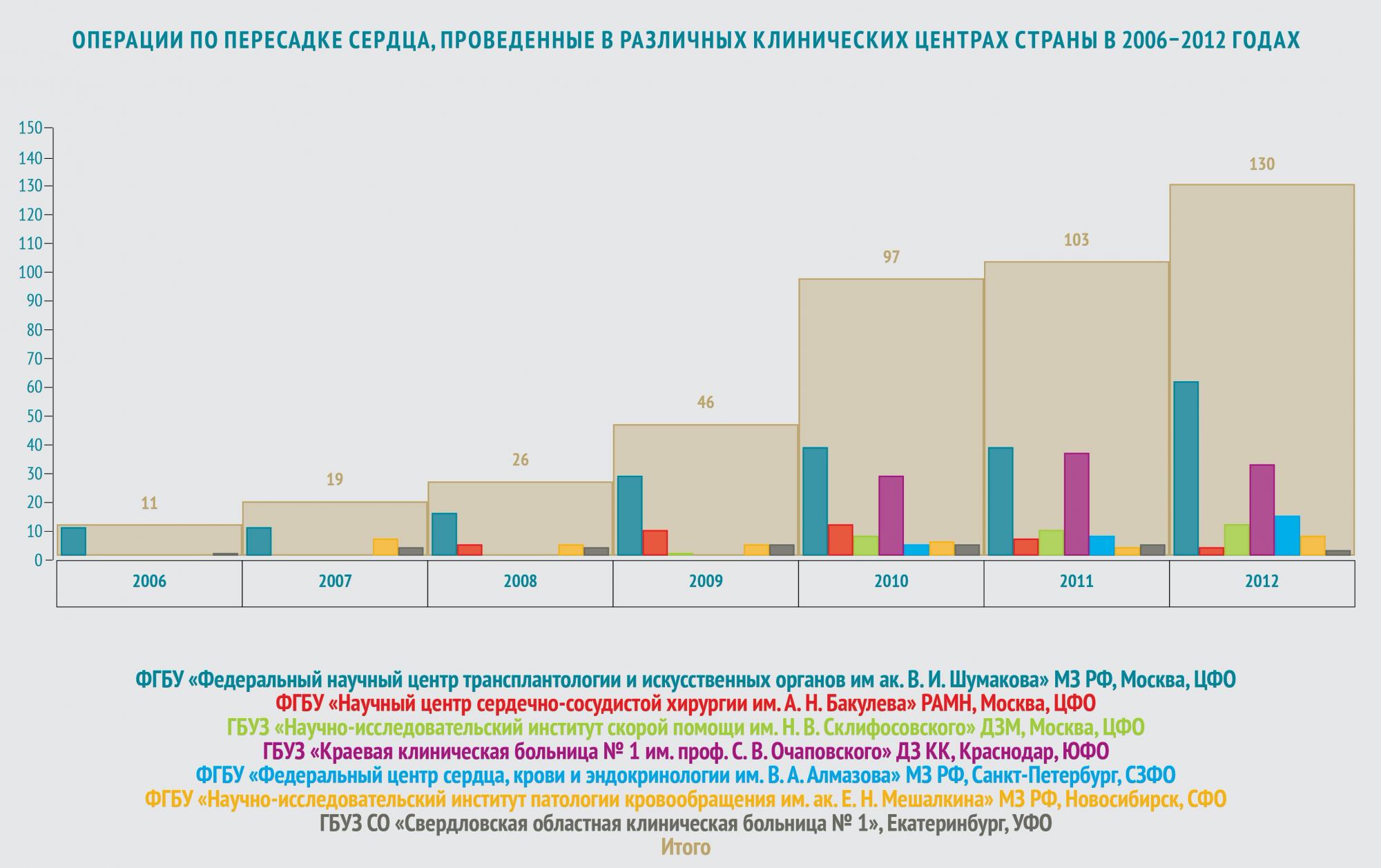
В мире ежегодно выполняется от 2,7 до 4,5 тысяч трансплантаций сердца. Из них в России — всего около 100 операций. Лидер по количеству трансплантаций — США: там проводится до двух тысяч пересадок сердца ежегодно.
На сегодняшний день в России существует 10 центров, осуществляющих трансплантацию сердца (все данные приведены в соответствии с информацией, опубликованной в журнале «Вестник трансплантологии» за 2009–2013 год).
Показания для проведения операции по пересадке сердца
Диагноз:
- кардиомиопатии различного генеза;
- доброкачественные опухоли сердца;
- неоперабельные врожденные пороки сердца (например, гипоплазия левого желудочка).
Клинико-функциональная характеристика пациентов:
- хроническая сердечная недостаточность III-IV ФК по NYHA, резистентная к медикаментозной терапии;
- фракция выброса ЛЖС < 30%;
- конечно-диастолический размер ЛЖС > 7 см;
- конечно-диастолическое давление ЛЖС > 20 мм рт. ст.
- сердечный индекс (CI) < 2,5 л / (мин × м2);
- рефрактерность желудочковых тахиаритмий;
- ожидаемая выживаемость потенциального реципиента без трансплантации сердца < 6–12 мес.;
- возраст до 55 лет.
Абсолютные противопоказания:
- стойкая легочная гипертензия (транспульмональный градиент давления > 15 мм рт. ст., общее легочное сопротивление (ОЛС) > 5 ед. Вуда, систолическое давление в легочной артерии более 60 мм рт. ст.);
- острые инфекционные заболевания и/или обострение хронических;
- необратимая полиорганная недостаточность;
- злокачественные новообразования в анамнезе;
- тромбофлебит;
- системные заболевания;
- ожирение (> 30 % должной массы тела);
- психические заболевания, алкоголизм, наркомания;
- недисциплинированность в приеме медикаментов, несоблюдение больничного режима.
Относительные противопоказания
- активный диффузный миокардит;
- инсулинозависимый сахарный диабет;
- язвенная болезнь желудка и двенадцатиперстной кишки в стадии обострения;
- нарушение мозгового кровообращения в анамнезе;
- инфицирование вирусами гепатита С и гепатита В;
- атеросклероз сосудов нижних конечностей;
- ограниченная поддержка семьи.
Задачи на будущее
Только порядка 10–15 % больных, ожидающих трансплантацию сердца, доживают до ее проведения. Один из вариантов продления жизни до момента операции — установка искусственного сердца. Средняя выживаемость пациентов с таким протезом — около года. Если за это время подходящего донора не нашлось, больной может погибнуть, как правило, из-за тромботических осложнений. К сожалению, гемодинамические характеристики искусственных сердец пока далеки от совершенства. Новейшее достижение в этой области принадлежит немецкой компании «Berlin Heart»: разработчики заменили механические подшипники прибора миниатюрной турбинкой, подвешенной в управляемом магнитном поле. Это позволило значительно снизить тромбообразование в протезированном сердце.
Член Совета Европейского общества трансплантологов, директор НИИ трансплантологии и искусственных органов академик РАМН Сергей Готье в «Вестнике трансплантологии и искусственных органов» (№ 3, 2012 год) отмечает, что главная причина, по которой в нашей стране не выполняется необходимое количество трансплантаций, — отрицательное отношение населения к посмертному донорству органов. Нужно отметить, что в России, в отличие от США и стран Западной Европы, действует презумпция согласия: закон допускает изъятие тканей и органов у трупа, если умерший или его родственники не выразили своего несогласия.
Интересная методика, позволяющая продлить жизнь ожидающим пересадку сердца пациентам с дилатационной кардиомиопатией, разработана в 2002 году специалистами Научного центра хирургии РАМН во главе с доктором медицинских наук Алексеем Коротеевым. Его команда успешно опробовала на практике следующую методику: после курса интенсивной кардиотерапии больному делают спиральную томографию, чтобы создать точную трехмерную компьютерную модель сердца. Затем по индивидуальному муляжу шьется сетка из специального полиэфирного материала – дакрона. В ходе последующей операции сетку надевают на живое сердце, что препятствует дальнейшей дилатации.
До сих пор актуален поиск эффективной терапии послеоперационных осложнений. Большинство из них (инфекции, саркома Капоши, поражение почек и печени, а также быстрое развитие атеросклероза коронарных сосудов трансплантата) развиваются из-за постоянного использования иммуносупрессоров.
Возможно, когда-нибудь этих проблем удастся избежать, например, «вырастив» для пациента его собственное сердце in vitro из стволовых клеток. В апреле 2006 года ученые калифорнийского Института регенеративной медицины под руководством доктора Энтони Аталы сообщили об успешном выращивании и пересадке пациентам купола мочевого пузыря. Но структурированную ткань сердечной мышцы ни одному коллективу исследователей вырастить не удалось, по крайней мере, пока.
6693 просмотров
Поделиться ссылкой с друзьями ВКонтакте Одноклассники
Нашли ошибку? Выделите текст и нажмите Ctrl+Enter.

 Катрен Стиль
Катрен Стиль


зарегистрированным пользователям