Замена оригинального препарата на дженерик, подбор аналогов лекарств - очень частая ситуация в аптеке. Это происходит и из‑за того, что нужного препарата не оказывается на полке, и из‑за того, что пациентпросит произвести замену препаратов на более дешевые аналоги. Сэкономить деньги дженерики помогают не только пациентам, но и системе здравоохранения в целом. Цена на воспроизведенное лекарственное средство может быть ниже стоимости оригинального почти на 80 %. Это заставило некоторые страны внимательно отнестись к вопросам генерической замены. США, Канада, Германия, Великобритания и еще ряд стран Европейского союза объявили о том, что увеличение доли дженериков в общей структуре потребления лекарственных средств является стратегической задачей. Мировое потребление дженериков постоянно растет. По данным IMS Health, в период c 2005 по 2010 г. оно выросло с 124 до 234 миллиардов долларов США. По прогнозам компании, к 2015 г. потребление дженериков возрастет еще почти в два раза и составит 400–430 млрд долларов США.
Замена лекарств аналогами может происходить по разным причинам и описываться различными терминами. В частности, врач может заменить один препарат другим препаратом того же класса — это терапевтическая замена, которая может быть произведена только специалистом-медиком. В аптеке, без консультации с врачом, может происходить замена одной лекарственной формы на другую, замена оригинального препарата на дженерик или одного дженерика — на другой в рамках одного международного непатентованного названия (МНН). Во всех перечисленных случаях специалисту аптеки необходимы данные о взаимозаменяемости препарата.
В зарубежных источниках взаимозаменяемость (interchangeability) понимают как медицинскую или фармацевтическую практику перехода с одного лекарственного средства на другое, эквивалентное ему при одинаковых показаниях. А термин замещаемость (substitution or substitutability) относится к аптечной практике и характеризует замену в аптеке одного лекарственного средства на другое эквивалентное и взаимозаменяемое лекарственное средство без требования консультации с врачом, назначившим препарат. Законодательное регулирование замещения в разных странах различается.
В отечественной практике понятия взаимозаменяемости и замещаемости законодательно не закреплены. Сейчас готовятся поправки к Федеральному закону «Об обращении лекарственных средств», в том числе предполагается внесение в закон понятия о взаимозаменяемом лекарственном препарате. На сегодняшний день предлагается следующая трактовка этого термина:
«Взаимозаменяемый лекарственный препарат — лекарственный препарат с доказанной терапевтической эквивалентностью в отношении оригинального лекарственного препарата или, в случае его отсутствия в обращении, в отношении препарата сравнения, применяемый по одним и тем же показаниям, имеющий одинаковый качественный и количественный состав действующих веществ, а также лекарственную форму, дозировку и способ введения».
Следует отметить, что в предыдущей версии поправок в ФЗ «Об обращении лекарственных средств» предлагалась несколько иная трактовка понятия взаимозаменяемость:
«Взаимозаменяемый лекарственный препарат — лекарственный препарат, не являющийся биологическим лекарственным препаратом, с доказанной терапевтической эквивалентностью в отношении оригинального лекарственного препарата или, в случае его отсутствия в обращении, в отношении препарата сравнения, применяемый по одним и тем же показаниям, имеющий одинаковый качественный и количественный состав действующих веществ, а также лекарственную форму, дозировку и способ введения».
Казалось бы — небольшая разница в понятиях. Но на самом деле эта разница (имеется в виду исключение возможности взаимозаменяемости биологических лекарственных препаратов) имеет очень важное значение, в том числе и в сфере государственных закупок. Учитывая, что многие биологические лекарственные препараты входят в различные программы финансирования и государство инвестирует большие средства в бесплатное обеспечение населения этой группой препаратов, данный вопрос находится в центре активных дискуссий фармацевтического сообщества.
Каким в итоге будет понятийный аппарат в законе, покажет время, однако уже сегодня можно определить ключевые вопросы, которые встают перед специалистом аптеки при необходимости заменить оригинальный препарат на дженерик или биосимиляр.
Взаимозаменяемость лекарств: дженерики и биосимиляры
Отдельного рассмотрения требуют два вопроса — взаимозаменяемость оригинальных препаратов и дженериков, а также оригинальных биотехнологических препаратов и биосимиляров.
Дженерики
В России дженериком признается препарат, который обладает фармацевтической (химической) эквивалентностью и биоэквивалентностью (ФЗ № 61 «Об обращении лекарственных средств»). Фармацевтическая эквивалентность подразумевает, что дженерик эквивалентен оригинальному препарату по составу активных веществ, по силе действия или концентрации активных веществ, по идентичности лекарственных форм, по способу введения. Биоэквивалентность означает эквивалентность по фармакокинетическим параметрам. Два препарата признаются биоэквивалентными, если они обладают одинаковой степенью и скоростью всасывания, распределения и вывода лекарственного средства из организма.
Казалось бы, при фармацевтической и биологической эквивалентности препараты должны быть идентичными по своему воздействию на пациента. Однако существуют исследования, показывающие, что это так не во всех случаях. Например, в 2000 г. было опубликовано исследование авторов С. В. Недогода, И. В. Марченко, Т. А. Чаляби, в котором изучалась клиническая эффективность четырех генерических эналаприлов от известных производителей. Исследование показало, что эффективность по достижению целевого уровня артериального давления у исследуемых препаратов была ниже, чем у оригинального препарата, хотя все анализируемые дженерики были биоэквивалентны оригиналу. В итоге был сделан вывод о различной терапевтической эквивалентности воспроизведенных препаратов эналаприла.
Поскольку дженерики и оригинальные препараты могут быть различными по своему терапевтическому воздействию, в некоторых странах не все генерические препараты считаются взаимозаменяемыми. Например, в США еще с 1984 года дженерики признаются терапевтически эквивалентными только в том случае, если они фармацевтически эквивалентны друг другу и в равных дозах оказывают одинаковое действие с равной выраженностью побочных эффектов у одинаковых пациентов. Управление по контролю за пищевыми продуктами и лекарственными препаратами США (FDA) ежегодно издает перечень одобренных к применению препаратов с доказанной терапевтической эквивалентностью — «Оранжевую книгу» (Orange-book). В этом издании не все лекарства, выпущенные в рамках одного МНН, признаются взаимозаменяемыми. Например, в соответствии с 32‑м изданием «Оранжевой книги» (2012 г.) флуконазол нескольких компаний не был признан как терапевтически эквивалентный, а значит — взаимозаменяемый. Дженерики, которые FDA признает терапевтически эквивалентными оригинальному лекарственному средству, автоматически считаются взаимозаменяемыми. Однако в некоторых штатах США могут действовать отдельные ограничения на замену лекарственных препаратов с узким терапевтическим индексом, даже если в «Оранжевой книге» они признаны терапевтически эквивалентными. Например, это сердечные гликозиды, иммунодепрессанты, противоэпилептические лекарственные средства.
Сегодня в странах Европейского союза, в США и в других странах разрешено замещение оригинальных препаратов дженериками. При этом в некоторых странах Евросоюза системой здравоохранения даже предусмотрено автоматическое замещение. Оно подразумевает, что при наличии в аптеке хотя бы одного дженерика, провизор обязан заменить им оригинальный препарат, выписанный врачом. В некоторых штатах США также действует система автоматического замещения, учитывающая рекомендации «Оранжевой книги».
Биосимиляры
Согласно современным исследованиям, произвести биотехнологический аналог, полностью аналогичный оригинальному препарату, достаточно непросто в связи с тем, что биотехнологические препараты представляют собой молекулу очень большого размера, имеющую сложную пространственную конфигурацию, и точно воспроизвести ее не всегда возможно. По этой причине за рубежом признается, что биосимиляры и оригинальные препараты не во всех случаях взаимозаменяемы и их замена осуществляется врачом, а не фармацевтом: «Так как биосимиляр подобен, но не идентичен оригинальному биотехнологическому лекарственному средству, решение о лечении биосимиляром должно приниматься с опорой на мнение врача», — (European Medicines Agency. Q&A document EMEA/74 562/2006 (Rev.1 22 October 2008)). Управление по контролю за пищевыми продуктами и лекарственными препаратами США (FDA) признает биосимиляр взаимозаменяемым, если он биоподобен оригинальному препарату; демонстрирует аналогичные результаты при применении у любого выбранного пациента; показывает тот же уровень безопасности и эффективности, что и оригинальное лекарственное средство.
Получение разрешения для вывода биосимиляра на фармацевтический рынок не гарантирует взаимозаменяемости.
Сегодня для снижения затрат правительства многих стран заинтересованы в широком применении биосимиляров при лечении пациентов. Однако эксперты системы здравоохранения отмечают, что возможное снижение затрат все же не должно служить поводом для того, чтобы разрешать автоматическую замену в аптеках оригинальных препаратов на биосимиляры. По мнению ВОЗ разрешение автоматического замещения оригинального биотехнологического лекарственного средства на биоподобные лекарственные средства должно приниматься на национальном уровне, с учетом профиля безопасности лекарства, а также с учетом научных и клинических данных. Во многих странах оригинальные биотехнологические лекарственные средства и биосимиляры не являются взаимозаменяемыми и выписываются по торговому названию, а не по МНН (Великобритания, Голландия, Польша, Дания, Норвегия, Австрия, Словакия, Франция и др.). В Японии действует схожее с европейским законодательство, регулирующее вопросы обращения биоподобных лекарственных средств и их взаимозаменяемость.
Сегодня необходимо создание руководств во всех странах мира по определению взаимозаменяемости биоподобных лекарственных средств на законодательном уровне. В России также планируется создание подобного документа. В частности, планируется создание перечня взаимозаменяемых лекарственных средств.
Дженерик (генерик) (в российском законодательстве этому термину соответствует синонимичное понятие — воспроизведенное лекарственное средство) — это лекарственное средство, содержащее такую же фармацевтическую субстанцию или комбинацию таких же фармацевтических субстанций в такой же лекарственной форме, что и оригинальное лекарственное средство, и поступившее в обращение после поступления в обращение оригинального лекарственного средства (ФЗ № 61 от 12 апреля 2010 г. «Об обращении лекарственных средств»).
Оригинальное лекарственное средство — лекарственное средство, содержащее впервые полученную фармацевтическую субстанцию или новую комбинацию фармацевтических субстанций, эффективность и безопасность которых подтверждены результатами доклинических исследований лекарственных средств и клинических исследований лекарственных препаратов (ФЗ № 61 от 12 апреля 2010 г. «Об обращении лекарственных средств»).
Биотехнологические лекарственные средства — иммунобиологические лекарственные средства, произведенные с помощью генной инженерии (документы Европейского медицинского агентства, EMA — European Medicines Agency). В российском законодательстве отсутствует определение биотехнологического лекарственного средства. В законе имеется лишь определение иммунобиологических препаратов.
Иммунобиологические лекарственные препараты — лекарственные препараты биологического происхождения, предназначенные для иммунологических диагностики, профилактики и лечения заболеваний (ФЗ № 61 от 12 апреля 2010 г. «Об обращении лекарственных средств»).
Биосимиляр — это биотехнологическое лекарственное средство, схожее с произведенным впервые оригинальным лекарственным средством и представленное на регистрацию после истечения срока действия патента оригинального препарата (Директива Евросоюза 2003 года.). В российском законодательстве понятие биосимиляра в настоящее время отсутствует. Однако, понятие биоаналогичного (биоподобного) включено в текст поправок.
Биоаналоговое (биоподобное) лекарственное средство (биоаналог) — биологическое лекарственное средство, схожее с оригинальным биологическим лекарственным средством по технологии производства, фармацевтической субстанции (комбинации фармацевтических субстанций), лекарственной форме, показаниям к применению и поступившее в обращение с соблюдением интеллектуальных прав на оригинальное лекарственное средство (Проект ФЗ «О внесении изменений в Федеральный закон «Об обращении лекарственных средств» и в статью 333.32.1. части второй Налогового кодекса Российской Федерации»).
Замена лекарства в аптеке
С 1 июля 2013 года вступает в силу Приказ Минздрава РФ от 20 декабря 2012 г. № 1175н «Об утверждении порядка назначения и выписывания лекарственных препаратов, а также рецептурных бланков на лекарственные препараты, порядка оформления указанных бланков, их учета и хранения». После этого во всех рецептах врачи будут указывать только МНН. Что это означает для специалистов аптек?
После вступления приказа в силу на плечи аптечных работников ложится ответственность по выбору лекарственного средства в рамках одного МНН. Рекомендация провизора будет являться одним из ключевых факторов при выборе лекарственных препаратов пациентом. Исследовательская компания Synovate Comcon в 2010 году опубликовала результаты опроса пациентов, показавшие, что среди факторов, влияющих на выбор препарата посетителем аптеки, на третьем месте (после рекомендации врача и наличия скидок) стоит рекомендация аптечного работника.
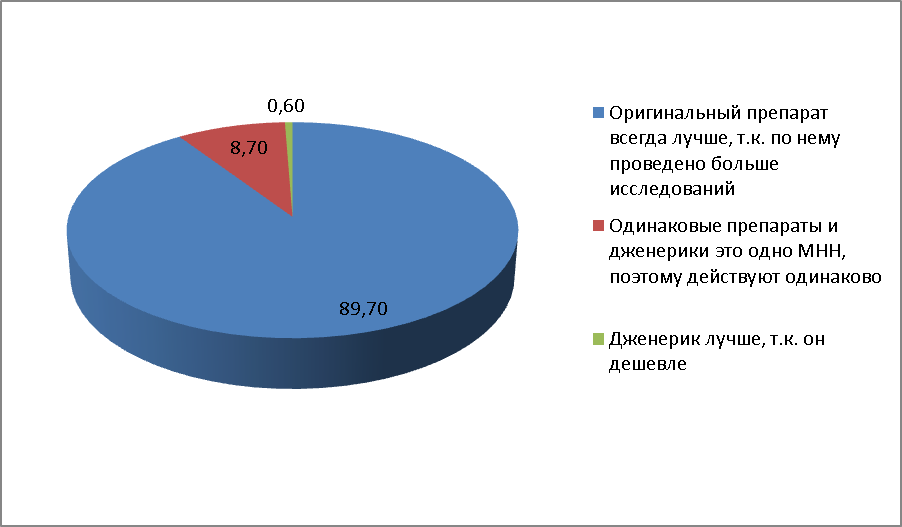
В 2011 году той же компанией было опубликовано исследование, как фармацевты и провизоры относятся к оригинальным препаратам и дженерикам. Исследование показало: 89,7 % опрошенных считают, что оригинальный препарат всегда лучше, чем дженерик, поскольку по нему проведено больше исследований. Лишь 8,7 % опрошенных сообщили, что оригинальные препараты и дженерики действуют одинаково, поскольку выпущены в рамках одного МНН. Наконец, 0,6 % опрошенных считают, что дженерик лучше, поскольку дешевле.
Несмотря на такое отношение к оригинальным препаратам и дженерикам, сотрудники аптек регулярно сталкиваются с необходимостью рекомендовать тот или иной дженерик. Это происходит, когда нужное лекарственное средство отсутствует в аптеке и когда тот или иной препарат недоступен пациенту по цене. Каким образом действовать специалисту аптеки при выборе нужного препарата?
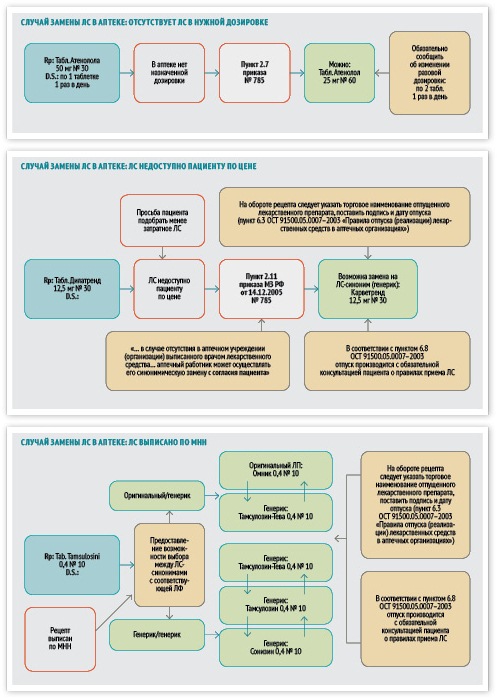
Шаг 1. Экспертиза рецепта. В первую очередь специалист должен провести экспертизу рецепта. Если рецепт оформлен неправильно, то он остается в аптеке и погашается штампом «Рецепт недействителен», Также специалист аптеки проводит проверку совместимости, дозировок и лекарственной формы препарата в соответствии с принципами фармакологии, фармацевтической технологии и фармацевтической химии.
Шаг 2. Отпуск препарата. Дальнейшие действия зависят от того, как выписан рецепт. Если в нем указан конкретный препарат, то специалисту аптеки остается только отпустить этот препарат или, при отсутствии нужного препарата, предложить синонимическую замену, другую лекарственную форму или препарат с другой дозировкой. Отпуск производится с обязательной консультацией пациента о правилах приема лекарственного средства. На обороте рецепта следует указать торговое наименование отпущенного лекарственного препарата, поставить подпись и дату отпуска.
Если же пациент принес рецепт, в котором указано МНН, то провизор должен предложить ему на выбор имеющиеся аналоги и синонимы лекарственных препаратов. При этом нужно учесть несколько принципов.
Во-первых, при выборе одного из синонимов может возникнуть ситуация, когда пациент приобретет препарат с другой дозировкой. В этом случае его необходимо предупредить, каким образом принимать препарат, чтобы соблюсти прописанную врачом дозировку.
Во-вторых, при рекомендации того или иного препарата необходимо учесть платежеспособность пациента. Если для него необходимо приобрести препарат по максимально сниженной цене, то желательно провести экспресс-оценку стоимости синонимов и предложить пациенту тот препарат, курс лечения которым будет стоить дешевле всего.
В-третьих, если у пациента нет предпочтений в выборе из нескольких лекарственных средств с одинаковым составом, формой выпуска, дозировкой и незначительными различиями в цене, то приоритет отдается тому препарату, который пациент принимал ранее (при хроническом заболевании), или препарату, который дольше других находится на фармацевтическом рынке и доказал свою эффективность и безопасность в повседневной практике.
При выборе того или иного препарата специалиста аптеки могут ждать «подводные камни». В частности, необходимо быть внимательным при рекомендации «фармацевтических альтернатив» (по определению FDA) — это препараты, которые содержат одинаковые терапевтические компоненты, но различаются по виду солей, эфиров или комплексам этих компонентов. Они могут иметь различную дозировку и силу действия. Также к фармацевтическим альтернативам относятся лекарственные средства с замедленным высвобождением по сравнению с лекарственными средствами, обладающими ускоренным или «нормальным» высвобождением.
«Альтернативы» могут оказывать на организм пациента различное действие, поэтому провизор должен не только знать, но и учитывать показания и противопоказания таких препаратов. Например, натриевая, калиевая и прокаиновая соли имеют одинаковое фармакологическое действие, фармакокинетику, показания к применению, взаимодействие и режим дозирования. Однако они различаются по дозам применения, побочным действиям и противопоказаниям. Например, натриевая соль противопоказана при эпилепсии (для эндолюмбального введения), калиевая соль — при гиперкалиемии, аритмии, а прокаиновая соль не имеет таких противопоказаний.
Для обеспечения полной безопасности пациентов при замене препаратов в аптеке важна разработка рекомендаций по взаимозаменямости препаратов. Кроме того, принципиальное значение имеет квалифицированный и ответственный подход специалистов аптеки к консультированию пациентов, приобретающий еще большее значение с введением выписки рецептов по международному непатентованному названию.
Статья написана по материалам: Ягудина Р. И., Аринина Е. Е., Кондратьева Б. Б. «Взаимозаменяемость и замещаемость лекарственных средств»//«Современная организация лекарственного обеспечения» № 1/2013


 Катрен Стиль
Катрен Стиль.png)


зарегистрированным пользователям