
Современные вызовы в области клинических исследований
На конференции ФМО эксперты обсудили актуальные изменения в законодательном регулировании клинических исследований
30 мая 2025 года Казань стала местом проведения сессии «Клинические исследования: современные вызовы». Мероприятие прошло в рамках конференции «Государственное регулирование в сфере обращения лекарственных средств — ФармМедОбращение — 2025». Модераторами выступили заведующий кафедрой фармации Института фармации и медицинской химии ФГАОУ ВО «РНИМУ им. Н.И. Пирогова» Минздрава России Анатолий Евгеньевич Крашенинников и руководитель департамента Росздравнадзора Татьяна Владиславовна Мурзич.
Открыла конференцию начальник отдела контроля клинических исследований Управления организации государственного контроля качества медицинской продукции Росздравнадзора Мурзич Татьяна Владиславовна. С её слов, «на фоне глобальных вызовов и стремительного развития биомедицинских технологий законодательство адаптируется к новым реалиям, обеспечивая баланс между инновациями, безопасностью пациентов и международной гармонизацией».
В прошлом году были внесены изменения в ФЗ № 61, направленные на его гармонизацию с правилами ЕАЭС, в том числе на единые требования к клиническим исследованиям. Таким образом:
- был отменён приказ № 200н;
- намечен глобальный тренд на цифровизацию, в том числе введение электронных форм информированных согласий в клинисследованиях.
Также изменились механизмы госрегулирования и контроля в клинических исследованиях (КИ): в приоритете сейчас профилактические мероприятия.
Изменения произошли и в международном законодательстве: в начале этого года вступила в силу редакция СH GCP (Руководство по надлежащей клинической практике), направленная на ужесточение требований к прозрачности данных и этике, рискоориентированный мониторинг, а также цифровизацию и внедрение технологий искусственного интеллекта (ИИ). Кроме того, присутствует сфокусированность на редких заболеваниях: растёт интерес к орфанным препаратам, таргетной и персонифицированной терапии.
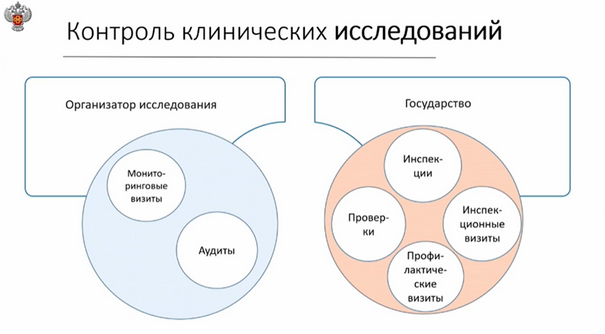
Какие нормативные акты регулируют проведение КИ
В отношении государственного контроля за клиническими исследованиями, Татьяна Владиславовна сообщила, что плановые контрольные мероприятия на сегодняшний день временно приостановлены в соответствии с ПП РФ № 336. Осуществляются только внеплановые проверки на основании ст. 57 ФЗ № 248, которая, согласно последним изменениям, подразумевает приоритет проведения профилактических мероприятий.
Контрольно-надзорные мероприятия проводятся в соответствии со следующими нормативными актами:
- Решение совета ЕЭК № 79 «О Порядке взаимодействия государств — членов Евразийского экономического союза при профилактике, диагностике, локализации и ликвидации очагов особо опасных, карантинных и зоонозных болезней животных и проведения регионализации и компартментализации».
- Решение совета ЕЭК № 77 «Об утверждении Правил надлежащей производственной практики Евразийского экономического союза».
- ПП РФ от 13.09.2010 № 714 «Об утверждении Типовых правил обязательного страхования жизни и здоровья пациента, участвующего в клинических исследованиях лекарственного препарата».
- ФЗ от 12.04 2010 № 61 «Об обращении лекарственных средств».
- ФЗ от 21.11.2011 № 323 «Об основах охраны здоровья граждан в Российской Федерации».
- Приказ Минпромторга России от 14.06.2013 № 916 «Об утверждении правил надлежащей производственной практики».
- Приказ Росздравнадзора от 17.06.2024 № 3518 «Об утверждении порядка фармаконадзора лекарственных препаратов для медицинского применения».
Безопасность превыше всего
Следующий доклад был представлен заведующим кафедрой фармации Института фармации и медицинской химии ФГАОУ ВО им. Н. И. Пирогова Минздрава России Крашенинниковым Анатолием Евгеньевичем и посвящён оценке безопасности в рамках клинических исследований. В нём были озвучены основные проблемы в этой области. В частности, относительно:
- отбора пациентов (неправильно выбранные критерии включения и исключения, которые могут искажать результаты исследования, приводя к смещению выборки);
- качества дизайна исследования (недостаточная рандомизация: несоблюдение принципа случайного распределения пациентов по группам лечения и контроля приводит к систематическим ошибкам; отсутствие плацебо-контроля: исследования без группы сравнения неэффективны для оценки истинного эффекта исследуемого препарата;
- наблюдения и регистрации данных (недостаточный контроль за соблюдением протокола исследования может привести к нарушению последовательности действий и некорректному сбору данных; некорректная регистрация побочных эффектов: недостаточно точное фиксирование нежелательных явлений негативно сказывается на оценке безопасности препарата);
- интерференции внешних факторов (недостаточный учёт сопутствующих заболеваний и социально-экономических факторов);
- этики клинического исследования (неполное информирование пациента о целях и рисках исследования; влияние коммерческих интересов спонсоров, искажающие дизайн исследования и его результаты.
Спикер подчеркнул, что в клинических исследованиях нужно сосредоточиться на этических аспектах. Основные цели — это, во‑первых, не причинить вред участникам КИ и, во‑вторых, доказать эффективность или безопасность препарата.
Российские разработки: прорыв в лечении
Аполлинария Васильевна Боголюбова-Кузнецова, заведующая лабораторией трансляционной иммунологии ФГБУ НМИЦ гематологии Минздрава России, представила доклад о клиническом исследовании анти-CD19 CAR-T-клеточного препарата «Утжефра». Это лекарство стало первым отечественным CAR-T-клеточным средством для лечения злокачественных заболеваний крови. Его разработали в Национальном медицинском исследовательском центре гематологии Минздрава России.
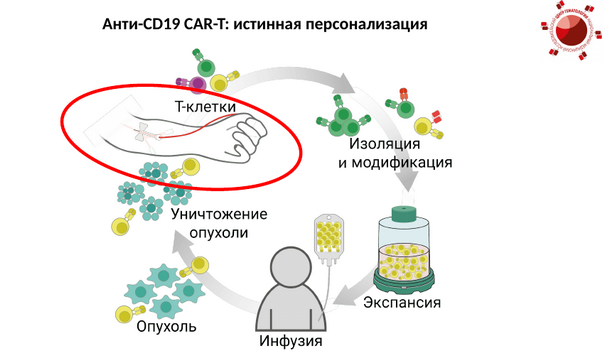
Со слов спикера, САR-Т-клеточная терапия — это пример истинной персонализации. «У пациента забираются его собственные Т-клетки, далее происходит их изоляция и генетическая модификация с целью появления на поверхности экспрессии химерного антигенного рецептора, после чего проходит … их экспансия и дальнейшая инфузия пациенту, и непосредственно в пациенте при помощи этих модифицированных CAR-T-клеток и достигается персонализированное уничтожение опухоли», — пояснила Аполлинария Васильевна.
ФГБУ НМИЦ гематологи провёл все необходимые доклинические исследования и в сентябре 2024 года получил лицензию Минпромторга России на производство геннотерапевтических препаратов. В середине ноября 2024 года началось клиническое исследование «Утжефра».
На данный момент проходит II фаза клинических испытаний:
- общий размер выборки: 60 пациентов в возрасте 18–70 лет;
- включено в исследование: 34 человека;
- успешно прошли скрининг: 28 пациентов;
- получили препарат: 25 лиц;
- исключены из исследования: 7 пациентов;
- прошли оценку первичной конечной точки эффективности: 18 человек.
Спикер сообщила, что данные по безопасности и эффективности препарата в целом сопоставимы с зарубежными аналогами.
Учёные считают, что «Утжефра» должен быть признан высокотехнологическим лекарственным препаратом в рамках ФЗ № 61. Это позволит использовать его не только в НМИЦ гематологии, но и в других медицинских учреждениях страны.
Нововведения в области регулирования этических принципов
Лариса Иванова Лаврентьева, директор института фармации ЯГМУ и заведующая кафедрой управления и экономики фармации, представила доклад «Совет по этике: анализ работы», подготовленный совместно с ректором ЯГМУ, академиком РАН, профессором А. Л. Хохловым. Спикер рассказала о нормативных актах, регулирующих этические принципы клинических исследований. К ним относятся:
- «Хельсинкская декларация Всемирной медицинской ассоциации. Этические принципы проведения медицинских исследований с участием человека в качестве субъекта» (Принята в г. Хельсинки в июне 1964 года на 18-й Генеральной Ассамблее ВМА);
- «ГОСТ Р 52379–2005. Национальный стандарт Российской Федерации. Надлежащая клиническая практика» (утв. Приказом Ростехрегулирования от 27.09.2005 № 232‑ст);
- Федеральный закон от 12.04.2010 № 61 «Об обращении лекарственн«Об утверждении Правил надлежащей клинической практики Евразийскогоэкономического союза»;
- Приказ Минздрава России от 31.10.2024 № 586н об утверждении положения о совете по этике, порядка его создания, который вступил в силу с 1 января 2025 года.

В приказе Минздрава России от 31.10.2024 № 586н описаны принципы Совета этики: независимость, гласность, справедливость, соблюдение прав и свобод человека и гражданина, компетентность, ответственность экспертов за проведение и качество этической экспертизы.
Задачами совета являются проведение этической экспертизы и выдача заключения:
- об этической обоснованности клинического исследования;
- о возможности (невозможности) государственной регистрации ЛП, предназначенного для применения в условиях ЧС;
- о возможности (невозможности) государственной регистрации ЛП в случае дефектуры.
Согласно приказу, в Совет этики должны входить специалисты медицинских, научных и образовательных организаций ВО, а также представители общественных, религиозных и средств массовой информации.
Страхование пациентов
В завершение сессии выступил руководитель направления страхования пациентов ООО «Капитал Лайф Страхование Жизни» Баконин Василий Александрович с докладом «Обязательное страхование пациентов при проведении клинических исследований». По его словам, организация, проводящая КИ, обязана страховать своих пациентов в соответствии с ФЗ от 12 апреля 2010 № 61 и ПП РФ от 13 сентября 2010 года № 714.
Условия страхования едины для всех страховых компаний на рынке РФ:
- по смерти застрахованного лица — 2 млн рублей;
- установлению инвалидности — 1 группы (1,5 млн рублей), 2 группы (1 млн рублей), 3 группы (500 тыс. рублей);
- ухудшение здоровья — 300 тыс. рублей.
Спикер также отметил, что срок проведения клинического исследования никак не влияет на стоимость договора страхования. Срок, на который оформляется договор, должен быть не меньше срока проведения КИ.
Сегодня документы для страхования готовятся максимально быстро — в среднем за один день, особенно с учётом перехода на электронный документооборот. Это важно для спонсоров клинических исследований.
Также читайте о ключевых тезисах и актуальных изменениях в регулировании и соответствие стандартам ЕАЭС.
60 просмотров
Поделиться ссылкой с друзьями ВКонтакте Одноклассники
Нашли ошибку? Выделите текст и нажмите Ctrl+Enter.

 Катрен Стиль
Катрен Стиль


зарегистрированным пользователям