Череда поистине великих достижений в области генетики, молекулярной биологии и вирусологии связывает между собой литры жизненно необходимого инсулина и сою в колбасе, повседневный «ИФА на сифилис» и будущие сады на Марсе. Сугубо теоретические знания о структуре ДНК да лигазах-рестриктазах обернулись в недалеком прошлом вполне практической генетической инженерией. Полученные с ее помощью продукты могут обидно называться «генетически модифицированными» и стоить значительно дешевле на полке в супермаркете либо гордо именоваться «рекомбинантными» и быть заслуженно дорогими, находясь в аптеке. Последующее же неизбежное развитие генной инженерии, по разным прогнозам, может привести как к долгой счастливой жизни без голода и болезней, так и к зомби-апокалипсису в результате побега инфицированной мартышки от доигравшихся, наконец, ученых.
Суть вопроса
Генетическая (генная) инженерия — совокупность приёмов, методов и технологий, которые позволяют:
- получать рекомбинантные РНК и ДНК;
- выделять гены из организма (клеток);
- осуществлять манипуляции с генами и вводить их в другие организмы.
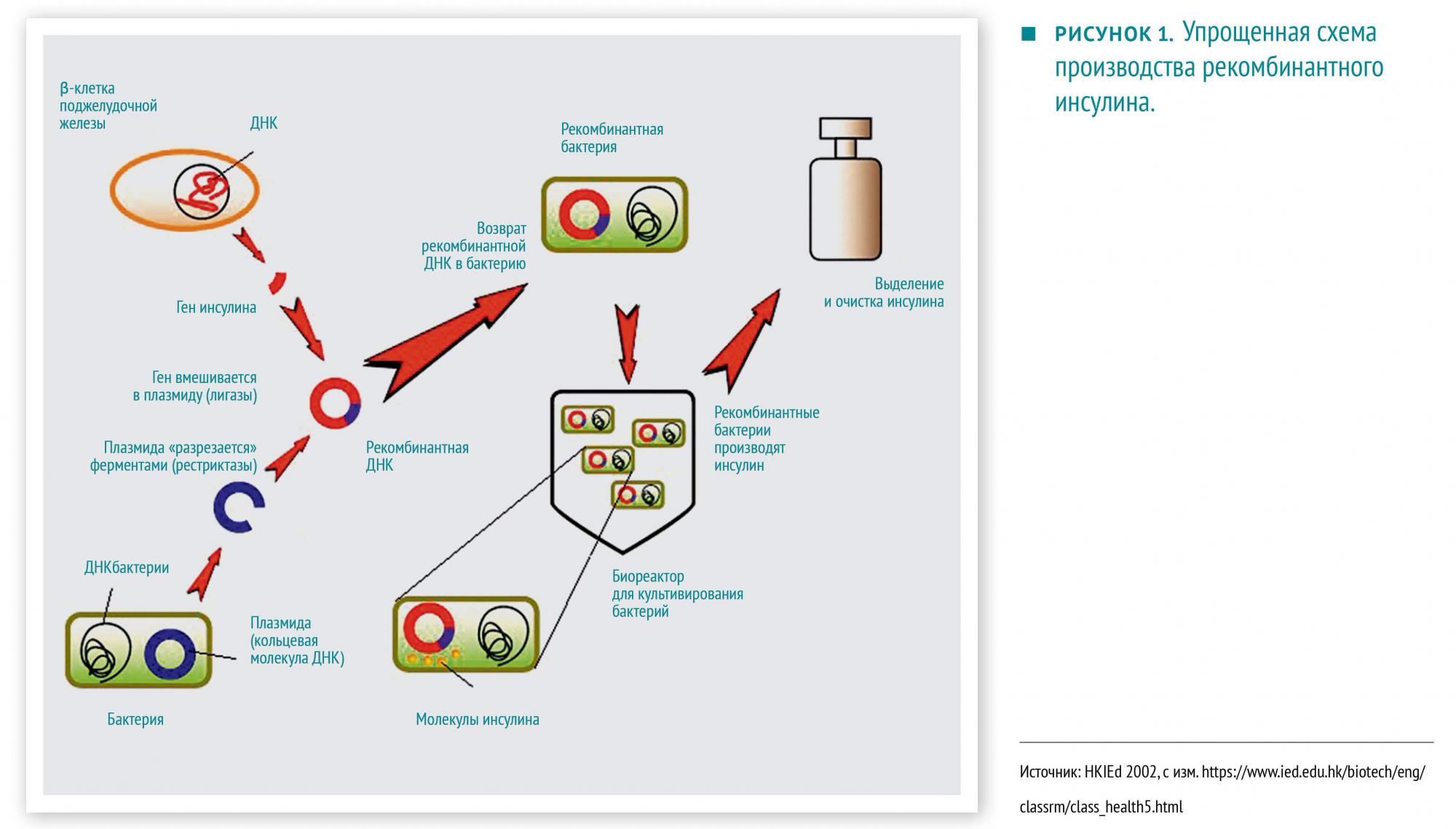
Свойства любого организма (цвет лепестков/шерсти/волос, способность усваивать глюкозу, возможность вырасти до 2 метров и т. д.) зависят от белков. Белки кодируются определенными генами. Ген можно «вырезать» из ДНК какого‑либо организма ферментами или, зная последовательность аминокислот в нужном белке, собрать ген этого белка из отдельных нуклеотидов, затем «вставить» его в ДНК бактерии (растения, животного), которая начнет производить заданный белок. За кажущейся простотой — десятилетия научного поиска, отмеченные несколькими Нобелевскими премиями.
Для тех, кто забыл
Вектор — молекула ДНК или РНК, способная переносить включенные в нее чужеродные гены в клетку.
Лигазы — ферменты бактерий и вирусов, которые соединяют концы двух фрагментов ДНК.
Плазмида — внехромосомная молекула ДНК бактерий или дрожжей, как правило, кольцевая, способная к автономной репликации. В генной инженерии используется как вектор.
Рестриктазы — ферменты бактерий, узнающие и атакующие определенные последовательности нуклеотидов в ДНК. В генной инженерии рестриктазы «вырезают» фрагменты из молекулы ДНК вектора, что позволяет вставить на освободившееся место нужный ген.
Значение генной инженерии для медицины
Продукты генной инженерии как‑то исподволь, но прочно вошли в медицинскую практику: лекарства для лечения редких болезней, рекомбинантный инсулин, вакцины против вируса гепатита В — без них современному врачу трудно представить себе мир. Генно-инженерными методами производят некоторые высокоселективные аллергены для кожных проб, некоторые реагенты для иммуноферментного анализа и многое другое. На этапе доклинических испытаний медикаментов приносятся в жертву миллионы генетически измененных животных. Ниже в порядке усложнения технологии и степени отрыва от реальности представлены основные примеры применения генной инженерии в медицине.
Сегодня на вооружении у врачей есть ряд препаратов, для которых критически важно точное соответствие аналогам в организме. Это препараты заместительной терапии при эндокринологических заболеваниях, гематологических болезнях (эритропоэтин, гранулоцитарный колониестимулирующий фактор, факторы свертывания крови, некоторые моноклональные антитела и др.), вирусных инфекциях (интерфероны), инфаркте миокарда и ишемическом инсульте (фибринолитики) и многих других.
Методы генной инженерии имеют следующие преимущества при получении такого рода лекарств:
- Идентичность веществ по структуре человеческим. Инсулин, производившийся из поджелудочных желез свиней и крупного рогатого скота, отличался от человеческого по одной и трем аминокислотам, соответственно, это часто приводило к нежелательным реакциям.
- Более низкая цена и удобное производство. Для получения 200 г сухого вещества того же инсулина требуется поджелудочных желез от более чем 6000 коров (или свиней). То же количество может быть произведено бактериями, содержащимися в 1000 л культуральной жидкости.
- Отказ от специфического сырья, которое полностью не очищается, например, гипофизы трупов использовались для получения соматотропного гормона, а моча женщин в менопаузе — традиционный источник фолликулостимулирующего и лютеинизирующего гормонов.
Лекарства из флоры и фауны
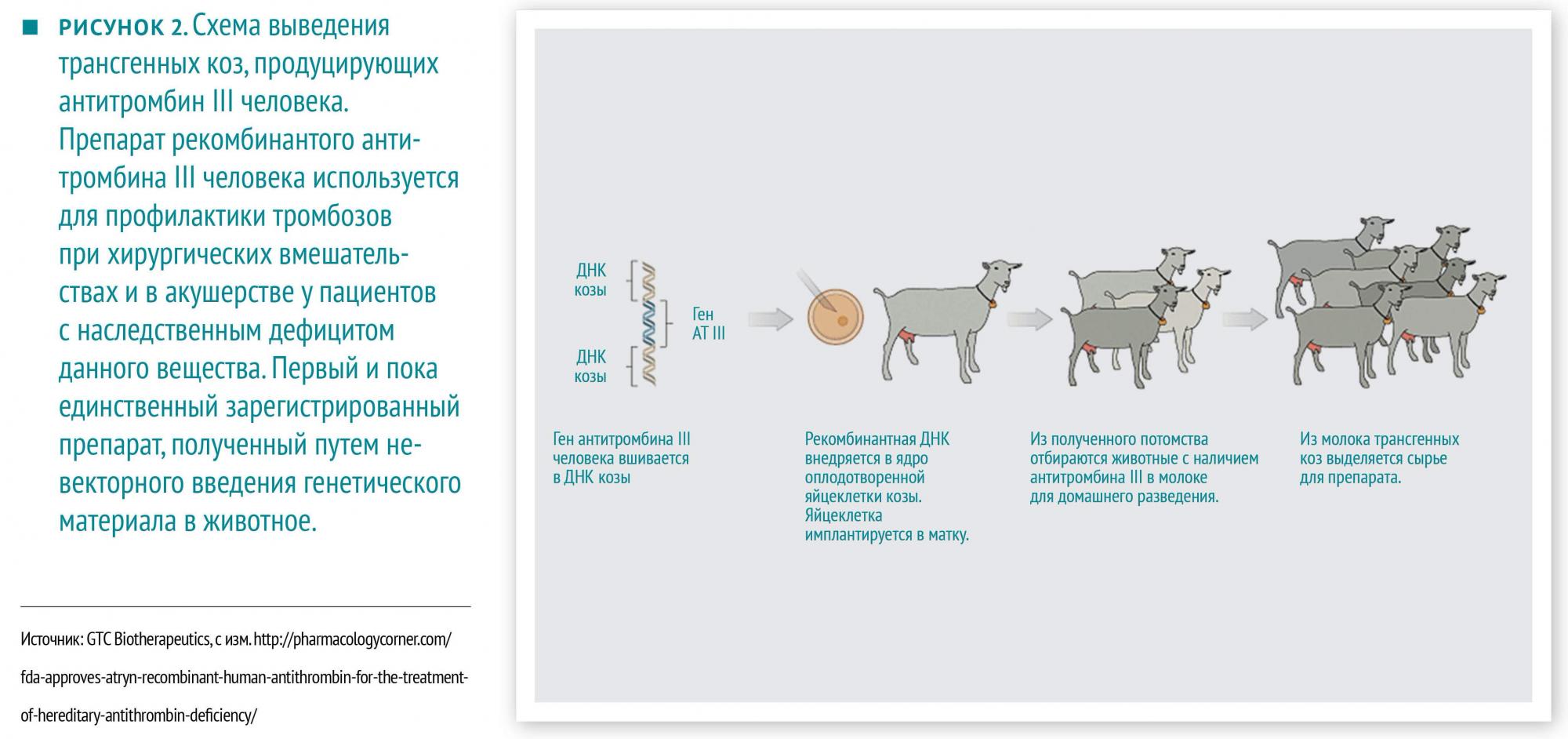
Бактерии и дрожжи, культуры клеток яичника китайского хомячка и моркови, продуцирующие сырье для препаратов, — это хорошо, но довольно дорого, к тому же сборка некоторых сложных молекул тем же бактериям недоступна из‑за биохимических различий с человеком. Идея перевода «биореакторов» на подножный корм или удобрения давно витала в воздухе. Механизм в целом тот же: нужный ген встраивается в ДНК животного или растения. ДНК микроинъекцией вводится в ядро оплодотворенной яйцеклетки, которая имплантируется в матку. Большинство эмбрионов, конечно, погибает, а среди родившихся животных далеко не все производят нужное вещество. Тем не менее на сегодняшний день мы имеем трансгенных коров, коз, свиней, кроликов, кур, лососей и шелкопряда. Из их биологических жидкостей в экспериментах получены человеческие α-антитрипсин, альбумин, гемоглобин, эритропоэтин, гормоны, факторы свертывания крови, шовный и перевязочный материал… Стоило ли ради свиной спермы отходить от женской мочи, пока не ясно, ведь сложности с очисткой сохраняются, да и цена этих препаратов с учетом технологического процесса всё еще будет очень высокой.
Растения-биореакторы удобнее тем, что лишены болезней млекопитающих, как правило, быстрее растут, проще и дешевле в разведении и хранении урожая. Ассортимент трансгенной флоры не уступит нашим рынкам в конце лета: от огурцов с подсолнухами до клубники и киви. «Любимая» же зелень генных инженеров-фармакологов — это табак, соя, картофель, рис и кукуруза. Набор возможных лекарств примерно соответствует «животным»: гормоны, гемоглобин, белки крови, моноклональные антитела для диагностики и лечения онкологии и вирусных инфекций, интерферон, а также антигены вирусов и бактерий — потенциальные вакцины. Ни одного препарата пока не зарегистрировано.
Плодовые вакцины
Логическое продолжение трансгенных растений — так называемые съедобные лекарства (в основном вакцины). В самом деле, зачем тратить время и средства на выделение белков холерного вибриона, малярийного плазмодия, вирусов гепатита В, бешенства и иммунодефицита человека из томатов, бананов и картофеля, если их можно съесть и так? По крайней мере, в опытах на мышах удается достигнуть развития иммунного ответа, и даже термическая обработка в ряде случаев не снижает эффективности съедобной вакцины. Антигены в кишечнике «встречаются» с антигенпрезентирующими клетками, далее всё, как обычно. Преимущества очевидны: очень дешево, вкусно и в большом количестве. Основные недостатки: возможность развития иммунологической толерантности вместо иммунного ответа, вариабельность содержания интересующего белка от плода к плоду даже с одного куста, и в итоге — неясность «дозирования».
Вакцины
«Австралийский антиген», белок оболочки вируса гепатита В и капсидные белки нескольких типов вируса папилломы человека для соответствующих вакцин продуцируют трансгенные дрожжи. Принцип тот же, что и с инсулином, только вместо человеческого синтезируется вирусный белок. Этим же путем идут создатели испытываемой сейчас противогриппозной вакцины, в основе которой лежит иммуногенный белок клеточной стенки М2, высококонсервативный, в отличие от почти ежегодно «обновляемых» гемагглютинина и нейраминидазы (тех самых «H» и «N» с порядковыми номерами в названии очередного подтипа вируса).
Также возможно создание вирусных и бактериальных векторов. При этом гены высокоиммуногенных белков вводятся в непатогенные вирусы и бактерии, после чего, например, штаммы шигелл начинают экспрессировать антигены малярийного плазмодия, а сальмонеллы — белки вируса иммунодефицита человека. Попадая в организм, такие «овцы в волчьих шкурах» индуцируют не только гуморальный, но и клеточный иммунный ответ. Особый плюс подобных «сальмонелльных» вакцин — это возможность их перорального приема, что значительно упростит иммунизацию населения и снизит уровень напряженности (и шума) в прививочных кабинетах детских поликлиник.



 Катрен Стиль
Катрен Стиль

зарегистрированным пользователям