Егор Баторов подготовил краткий обзор препаратов для активной специфической иммунотерапии онкозаболеваний
Я уже испробовал эти современные прививки.
Одних людей я с их помощью убил, других — спас, но я… никогда не знаю, которого из этих двух результатов смогу добиться.
Джордж Бернард Шоу «Врач перед дилеммой»
Идея вакцинации стара: разные способы прививки ослабленным возбудителем оспы (вариоляция) применялась в Китае с X века, Египте с XIII века, а в Европе с XVII века. Но только в конце ХХ века вакцины стали применять при онкопатологии, и это заставило иммунологов пересмотреть определение «вакцины».
На сегодняшний день вакцины — это ««препараты, содержащие антигенный материал, направленные на предотвращение и лечение инфекционных, опухолевых процессов, а также проявлений гиперчувствительности путем индукции эффекторных клеток и клеток памяти, оказывающих защитное действие».
Александр Александрович Ярилин
«Иммунология», 2010.
Первые документальные свидетельства стимуляции иммунной системы для уничтожения опухолевых клеток появились в XVIII–XIX веках. Тогда врачи связали случаи регрессии опухоли с развитием тяжелого инфекционно-воспалительного процесса в распадающихся массах или послеоперационной ране. Так, в 1867 году немецкий врач Буш сообщил о случае полного излечения пациента от злокачественной опухоли после заражения рожей. В 1885 году другой немецкий хирург Брунс намеренно сделал инъекцию стрептококков пациенту, чтобы вызвать рожистое воспаление, и зарегистрировал уменьшение опухоли. Также предлагалось накладывать на пораженные опухолью области повязки, пропитанные отделяемым больных рожей или гангреной, что иногда приводило к замедлению роста новообразования и даже к его исчезновению. Конечно, достоверность описываемых случаев — на совести авторов научных статей того времени.
В конце XIX — начале XX века американский хирург, онколог, иммунолог Вильям Коли (1862–1936), понаблюдав за парой клинических случаев регрессии саркомы, основательно изучив литературу и проведя несколько экспериментов над неоперабельными больными, развил эту идею. Он разработал препарат на основе убитых штаммов стрептококка (Streptococcus pyogenes, возбудитель рожистого воспаления кожи) и серраций (Serratia marcescens, условно-патогенная колиморфная бактерия). Токсин Коли вводился ежедневно в течение двух месяцев в опухолевую массу (большинство пациентов имели неоперабельные или рецидивировавшие саркомы костей и мягких тканей). Лучшие результаты были у лиц с реакциями, которые в наше время считаются нежелательными: лихорадкой, интоксикацией, выраженным ухудшением общего состояния [1]. Но в плане онкологии результаты были в целом положительными.
Однако дальнейшее развитие «иммунотерапии» онкозаболеваний было приостановлено. Причина тому — появление эффективных, стандартизованных и прогнозируемых методов лучевой и химиотерапии, в противовес непредсказуемости заражения и так тяжелых пациентов кустарно выращенными микробами.
В 1999 году Мэри Энн Ричардсон с соавторами из Национального института здоровья США сравнили эффективность токсина Коли и традиционной терапии. Ретроспективное сравнение 128 случаев применения «чудо-вакцины», опубликованных в 1890–1960 годах, сопоставимо с исходами химиотерапевтического лечения образца 1983 года (со скидкой на сопоставимость исследованных групп по диагнозам и приблизительность определения стадии болезни в начале прошлого века).
Профилактические вакцины
Сейчас существует только одна вакцина, которая позиционируется производителем как «профилактическая противоопухолевая». Это вакцина против вируса папилломы человека (ВПЧ) 16 и 18 типов, также обеспечивает перекрестный иммунитет против ВПЧ 31, 33, 45, 52 типов, «ответственных» за развитие 65–75 % случаев рака шейки матки. Вакцина состоит из рекомбинантных капсидных белков двух или четырех типов ВПЧ, собранных в вирусоподобные частицы. При введении препарата образуются плазматические клетки, продуцирующие вирус-нейтрализующие антитела, и В-клетки памяти.
В эпидемиологическом исследовании, проведенном в 2012 г. Центром по контролю и профилактике заболеваний США, было доказано, что вакцинация девушек 14–19 лет снижает носительство ВПЧ указанных типов на 56 % в популяции в целом и на 88 % среди привитых [2]. Стойкость ответа еще находится в процессе изучения, но не менее 4–7 лет.
Сейчас также ведутся разработки вакцин против вируса Эпштейна — Барр (играет роль в части случаев развития лимфопролиферативных заболеваний и назофарингеальной карциномы), Т-лимфотропного вируса человека (вызывает Т-клеточную лимфому/лейкемию), Helicobacter pylori (имеет значение в развитии рака желудка), вируса опухоли молочных желез человека (Human Mammary Tumor Virus, обнаруживается в 40 % случаев рака соответствующего органа) [3]. «Противоопухолевыми» эти вакцины будут в той же мере, что и существующая вакцина против вируса гепатита В, который ассоциирован с гепатоцеллюлярной карциномой.
Терапевтические вакцины
Большинство терапевтических вакцин стимулируют и поддерживают специфический клеточный иммунитет к опухоли. Для этого необходимо, чтобы антигенпрезентирующие клетки (АПК, как правило, это зрелые дендритные клетки) «представили» иммуногенный опухолевый антиген (или несколько антигенов) цитотоксическим Т-лимфоцитам (они же Т-киллеры). С этой целью можно:
- выделить и вернуть в организм антигены;
- получить генерацию дендритных клеток из моноцитов периферической крови и вернуть их,
- сделать и то и другое.
Сегодня повышенное внимание уделяется персонифицированным вакцинам, для изготовления которых используются клетки (опухоли и/или иммунной системы) конкретного пациента. Эти препараты сложнее стандартизовать, труднее оценить результаты лечения, а также наладить производство, способное удовлетворить потребности хотя бы областного онкодиспансера. Но поистине индивидуальный подход к пациенту и антигенам его опухоли подкупает своей перспективностью, и интерес общества и исследователей к ним возрастает год от года.
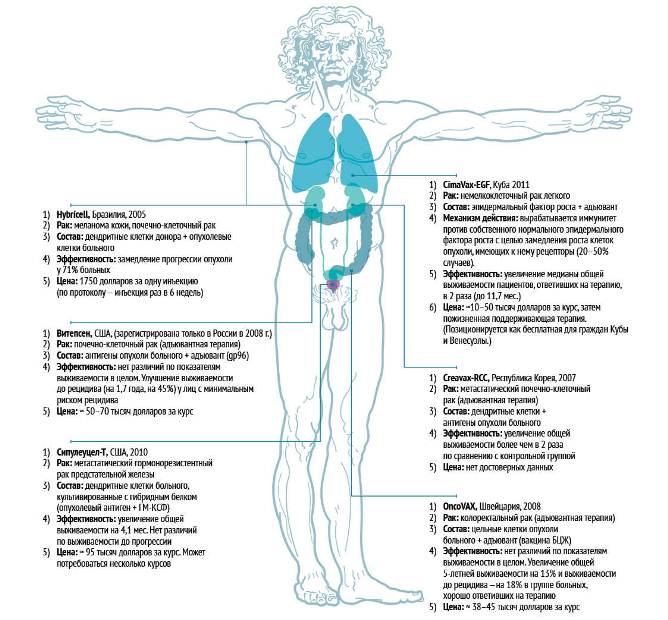
Важно понять, что активная специфическая иммунотерапия не излечивает от опухоли, а лишь увеличивает продолжительность и качество жизни в некоторых случаях. Перспективным может стать использование противоопухолевых вакцин в адъювантной терапии, то есть после хирургического удаления опухоли. Список дошедших до потребителя терапевтических вакцин короток. Сведения о них представлены на рисунке.
Наши разработки
Российские ученые тоже достигли определенных успехов в создании онковакцин, однако пока многолетние разработки находятся на стадии клинических испытаний.
Дендритноклеточные вакцины против меланомы, почечно-клеточного и колоректального рака испытывают в подразделениях НИИ онкологии им. Петрова Минздрава России (Санкт-Петербург) [6, 7], НИИ онкологии СО РАМН (Томск), а также в отделении экспериментальной диагностики и терапии опухолей Российского онкологического научного центра им. Блохина (Москва). По данным публикаций, ученым удалось добиться достоверного улучшения показателей выживаемости [5].
Успехов добились сотрудники лаборатории клеточных биотехнологий НИИ клинической иммунологии СО РАМН (Новосибирск), которые проводят ксеновакцинотерапию на основе лизатов чужеродных опухолевых клеток (линии меланомы и карциномы мышей). Это увеличивает иммуногенность препарата. Частичный ответ (уменьшение размера опухоли более чем на 50 %) и стабилизация (уменьшение размера опухоли менее чем наполовину) были достигнуты у 62 % пациентов с меланомой и у 42 % — с диссеминированным колоректальным раком, зафиксировано увеличение медианы выживаемости более чем в два раза по сравнению с контрольной группой [7]. Испытания проводятся также при других солидных опухолях. Подобные исследования проходят в Иркутске и Калининграде.
Резюме
При прочтении этого обзора может создаться впечатление, что горы рожают мышей. Однако здесь описаны только уже использующиеся препараты. Большое количество вакцин сейчас находится на разных стадиях клинических испытаний, и это про них время от времени СМИ несколько преждевременно пишут «ученые научились лечить рак».
- Hoption Cann S. A. et al. William Coley and tumour regression: a place in history or in the future // Postgrad Med J. — 2003. — Vol. 79, № 938. — P. 672–680.
- Markowitz L. E. et al. Reduction in Human Papillomavirus (HPV) Prevalence Among Young Women Following HPV Vaccine Introduction in the United States, National Health and Nutrition Examination Surveys, 2003–2010 // JID. — 2013. — Vol.208. — P. 385–293.
- Tuohy V. K., Jaini R. Prophylactic Cancer Vaccination by Targeting Functional Non- Self // Ann Med. — 2011. — Vol.43, № 5. — Р. 356–365.
- Барышников А. Ю. Принципы и практика вакцинотерапии рака // Бюллетень СО РАМН. — 2004. — № 112. — С. 59–63.
- Нехаева Т. Л. Оптимизация аутологичных дендритно-клеточных вакцин для лечения больных злокачественными новообразованиями // Сибирский онкологический журнал. — 2013. — № 57. — С. 52–56.
- Моисеенко В. М. и др. «Способ иммунотерапии костно-мозговыми предшественниками дендритных клеток, сенсибилизированных фотомодифицированными опухолевыми клетками in vivo, больных диссеминированными солидными опухолями» // Заявка на изобретение №2 008 115 173/14, приоритет от 17.04.2008.
- Суровцева М. А. и др. Клинико-иммунологическая эффективность вакцинотерапии при диссеминированной меланоме кожи // Сибирский онкологический журнал. — 2009. — № 36. — С.1 2–18.




 Катрен Стиль
Катрен Стиль


зарегистрированным пользователям