В большинстве случаев основа избирательной мальабсорбции витамина B12 и протеинурии — это мутация в одном из двух генов: кубилина (cubilin, CUBN) на хромосоме 10 или амнионлес (amnionless, AMN) на хромосоме 14. Оба белка входят в состав рецептора CUBAM энтероцитов и почечных канальцев, где рецептор отвечает за реабсорбцию белков.
В конце 2011 года в газете «Поиск» Российской академии наук появилась громкая новость — мутация в гене AMN, которая приводит к развитию синдрома Имерслунд — Гресбека, — вторая древнейшая мутация человека. Самой древней считается мутация муковисцидоза. Поломка в гене AMN возникла на Ближнем Востоке около 13 600 лет назад у одного человека, затем передавалась по наследству и в результате получила широкое распространение.
История открытия
Первым зарегистрированным случаем синдрома Имерслунд — Гресбека считается заболевание финского мальчика 11 лет. С двухлетнего возраста его лечили от мегалобластной анемии, которая периодически сопровождалась протеинурией. Случаем заинтересовался финский клинический биохимик Ральф Гресбек, который вместе с коллегой доложил о нем в Хельсинки на XII Северном педиатрическом конгрессе в 1958 году. Уже тогда они предположили, что нарушение всасывания витамина В12 связано с патологией рецепторов витамина в подвздошной кишке, и что, вероятно, повреждение почечных канальцев имеет тот же генез, поскольку энтероциты и эпителий канальцев во многом похожи. Чуть позже Гресбек встретился с подобными симптомами у студентки сестринского дела, что позволило ему связать эти два случая. И поскольку у девушки родители были близкими родственниками, он заключил, что, вероятно, имеет место наследственный характер синдрома.
Финские врачи во главе с Гресбеком досконально изучили оба случая. На основании полученных данных вышла публикация (Gräsbeck R. et al, B12 malabsorption and proteinuria in young people, Acta Med Scand, № 167, 1960), и в это же время стало известно, что в Норвегии аналогичный синдром у 10 пациентов из 6 семей описала педиатр Ольга Имерслунд в своей диссертационной работе (Imerslund O, Idiopathic chronic megaloblastic anemia in children, Acta Paediatr Scand Suppl, № 49, 1960). Все это позволило Имерслунд сделать следующие выводы: синдром наследуется аутосомно-рецессивно, секреция желудочного сока не нарушена, почечная функция, несмотря на протеинурию, не снижена. Кроме того, Имерслунд описала аномалии в мочевых путях (двойные мочеточники и подковообразная почка), однако доктор Брох, продолживший работу Имерслунд, не нашел связи синдрома с аномалиями развития мочевой системы. Наблюдаемые им 14 пациентов (6–46 лет) выделяли в сутки от 13 до 1460 мг белка (в среднем 750 мг). Диссертация Ольги так и не была принята, предположительно из‑за малого количества лабораторных данных.
После первых упоминаний об этом синдроме стали появляться всё новые и новые описания клинических случаев. К 1967 году было известно о 47 случаях. А к 2011 году было опубликовано 300 клинических случаев синдрома Имерслунд — Гресбека. В конце прошлого века были установлены генетические маркеры синдрома.
Этиология и патогенез
Один из ведущих симптомов — витамин-В12‑дефицитная (мегалобластная) анемия, поэтому синдром Имерслунд — Гресбека в МКБ относят к этому виду анемий. Напомним механизм поступления витамина B12 в кровь и его участие в биохимических процессах.
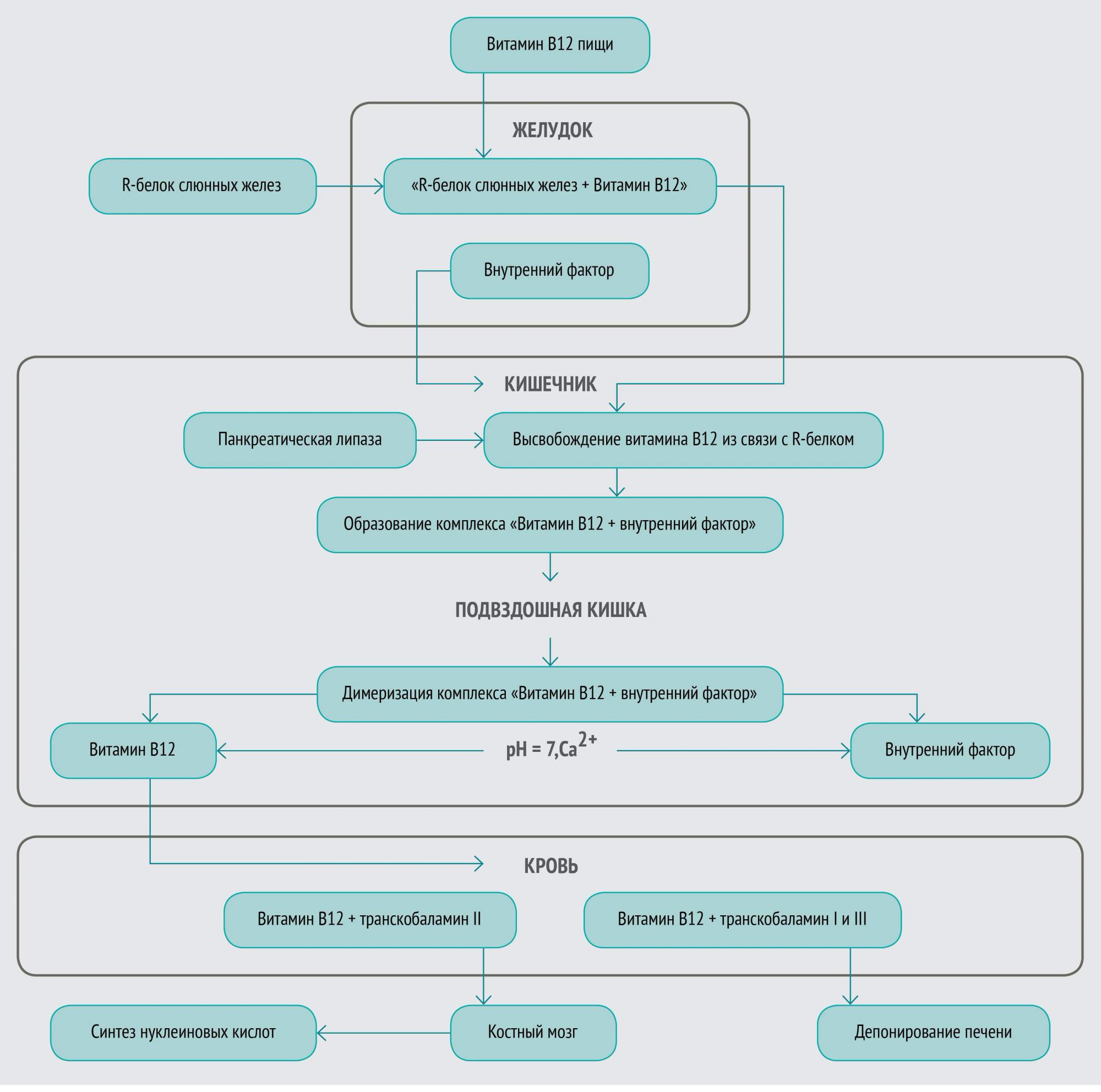
Витамин В12, получаемый человеком извне с пищей животного происхождения, называют внешним фактором Касла. Для его всасывания в кишечнике необходим внутренний фактор Касла — термолабильный гликопротеин с молекулярной массой порядка 50 000–60 000 дальтон, секретируемый париетальными клетками тела и дна желудка. В желудке витамин B12 высвобождается из пищи под действием соляной кислоты и соединяется с R-белком слюны. В двенадцатиперстной кишке R-белок расщепляется панкреатическими протеазами, и витамин B12 связывается с внутренним фактором (ВФ), что делает его устойчивым к действию протеолитических ферментов. Комплекс витамина В12 с ВФ затем абсорбируется в подвздошной кишке с помощью рецепторов в присутствии ионов кальция. Выйдя из энтероцита, витамин B12 в крови соединяется с белком-переносчиком транскобаламином и поступает в воротный кровоток печени.
Чистый витамин В12 в биохимических реакциях выступает как кофермент при синтезе тетрагидрофолиевой кислоты, метионина, тимина и, соответственно, белков и нуклеиновых кислот. Наиболее частая причина нарушения всасывания витамина B12 — атрофия слизистой желудка, при которой отсутствует секреция соляной кислоты, пепсина и внутреннего фактора.
При синдроме Имерслунд — Гресбека механизм нарушения всасывания витамина В12, по всей видимости, обусловлен наследственным изменением структуры белков, входящих в состав рецептора CUBAM, находящегося на поверхности энтероцитов и почечных канальцев.
Известно, что отсутствие абсорбции витамина происходит при нормальной секреции внутреннего фактора и антитела к внутреннему фактору не выявляются. Протеинурия остается после лечения больных витамином В12, т. е. в период гематологической ремиссии. При гистологическом исследовании почек в большинстве случаев патологических изменений обнаружить не удается. Изредка обнаруживают признаки хронического мембранозного гломерулонефрита.
Клиническая картина
Болеют дети обоих полов. Симптомы проявляются чаще всего до 2‑летнего возраста и, как правило, во втором полугодии первого года жизни, хотя встречаются редкие случаи, когда симптомы проявляются к 18‑летнему возрасту. Изредка синдром выявляется только при лабораторной диагностике.
Для развернутой клинической картины характерно поражение кроветворной ткани, пищеварительной и нервной систем. У детей отмечают вялость или раздражительность, беспокойство; снижение аппетита вплоть до анорексии; замедление весовых прибавок, отставание в физическом развитии. Возможны тошнота, рвота, диарея. Повышена восприимчивость к инфекциям. Постепенно нарастает бледность кожных покровов и слизистых, появляется субиктеричность. Характерны афтозный стоматит, глоссит, гепатоспленомегалия.
Характерная особенность В12‑дефицитной анемии — мегалобластный тип кроветворения, когда нарушается синтез нуклеиновых кислот, созревание и дифференцировка ядер эритрокариоцитов отстают от созревания цитоплазматических структур, в частности гемоглобина. Одновременно нарушается дифференцировка и других клеток миелоидного ряда: мегакариобластов и миелобластов.
Также характерным признаком является фуникулярный миелоз — подострая комбинированная дегенерация спинного мозга с поражением задних и боковых канатиков. Наиболее ранние признаки миелоза — парестезии, атаксия, гипорефлексия, выпадение чувствительности. Иногда у больных могут развиваться психические нарушения и галлюцинации. Без лечения у пациентов наблюдаются периоды спонтанной клинической ремиссии, сменяющиеся рецидивами. Заместительная терапия витамином B12 приводит к устойчивой ремиссии.
Диагностика и лечение
Дети с небольшой протеинурией и поведенческими отклонениями могут иметь недиагностированный синдром Имерслунд — Гресбека.
www.nature.com
Мегалобластная анемия у детей — серьезный повод заподозрить синдром Имерслунд — Гресбека. Картина крови представляет собой сочетание анизоцитоза эритроцитов наряду с очень крупными (более 12 мкм в диаметре) клетками — мегалоцитами; резчайший пойкилоцитоз, повышенное насыщение эритроцитов гемоглобином — гиперхромия, появление полисегментированных нейтрофилов, гиперхромный, реже нормохромный характер анемии, тромбоцитопения, лейкопения. Степень цитопении может быть различной, редко отмечается снижение уровня всех трех форменных элементов крови. Решающее значение в диагностике принадлежит исследованию костного мозга, которое обнаруживает резкое увеличение в нем числа элементов эритроидного ряда с преобладанием мегалобластов. Протеинурия без поражения почек и нарушения их функции позволяет поставить клинический диагноз синдрома Имерслунд — Гресбека. Однако для подтверждения диагноза необходим генетический тест на мутации в генах CUBN и AHM.
Поскольку ведущий симптом — витамин-В12‑дефицитная анемия, лечение заключается в пожизненном назначении инъекций витамина B12. Терапия позволяет сохранять здоровье, расти и развиваться соответственно возрасту. Однако протеинурия сохраняется. Прогноз благоприятен.
Клинический случай
Итальянские ученные во главе с Жанпауло Де Филиппо в 2013 году описали случай синдрома Имерслунд — Гресбека у 25‑месячной девочки. Девочка родилась на 38‑й неделе путем кесарева сечения. Семейный анамнез не был отягощена по каким‑либо наследственным заболеваниям. Вес при рождении — 2,950 кг, рост — 49 см. Период новорожденности прошел без особенностей. Вскармливание искусственное с рождения, дополнительно получала только препараты витамина D. Рост и вес до 3 месяцев был в пределах нормы, после 3‑х месяцев девочка стала плохо набирать в весе, и рост перестал соответствовать возрастной норме. Психомоторное развитие было нормальным. В 21 месяц девочка начала терять аппетит, появился запор, плохо корректирующийся слабительными. К 24 месяцам она потеряла еще 200 г веса, началась рвота один раз в день в течение недели до госпитализации. На момент госпитализации девочка была вялой, бледной. Вес — 9,370 кг, рост — 85 см (25‑й процентиль, ниже среднего) и окружность головы — 49 см (75‑й процентиль, выше среднего). Пульс — 120 ударов в минуту, артериальное давление 80/50 мм рт. ст., а температура 36,6 °C. При аускультации легких и пальпации живота особенностей не выявлено, кожа сухая. Неврологический статус также без особенностей. Гематологические параметры указывали на макроцитарную анемию. Периферический мазок показал наличие нейтрофильных гранулоцитов увеличенного размера, с полисегментарными ядрами. Все остальные биохимические показатели были в норме (проверяли функции печени, почек и щитовидной железы, воспалительные маркеры, маркеры мальабсорбции и целиакии). Выделение с мочой общего белка и альбумина не превышало нормы. Лечение было начато с парентерального введения витамина В12 (500 мкг/день, в течение 5 дней) и привело к быстрому улучшению состояния, рвота прекратилась, аппетит улучшился. В течение последующих трех лет на фоне базовой терапии витамином В12 (1000 мкг/день, парентерально) девочка хорошо прибавляла в весе и росте, психомоторное развитие соответствовало возрасту. Гематологические параметры нормализовались и оставались стабильными. Для обоснования клинического диагноза был проведен генетический анализ генов АМН и CUBN. Пациентка оказалась гомозиготой по мутации гена АМН.
- Заболевания крови, Андрей Дроздов, 2008.
- Патофизиология Новицкого, Е. Д. Гольдберга. Том 2–2009.
- Gianpaolo De Filippo et al., Imerslund-Gräsbeck syndrome in a 25‑month-old Italian girl caused by a homozygous mutation in AMN, Italian Journal of Pediatrics, 2013, № 1.
- Stephan M. et al. Genetically heterogeneous selective intestinal malabsorption of vitamin B12: Founder effects, consanguinity, and high clinical awareness explain aggregations in Scandinavia and the Middle East, Human Mutation, 2004, № 23 (4).
- Kishan P. et al. Unusual Cause of Childhood Anemia: Imerslund Grasbeck Syndrome, J Lab Physicians, 2011, № 3 (2).



 Катрен Стиль
Катрен Стиль

зарегистрированным пользователям