Остеопороз у семилетнего мальчика
Семилетнего ребенка беспокоили боли в спине
По материалам: Osteoporosis resulting from acute lymphoblastic leukemia in a 7-year-old boy: a case reportHendra Salim, Ketut Ariawati, Wayan Bikin Suryawan, Made ArimbawaJournal of Medical Case Reports 2014, 8:168
Источник: www.jmedicalcasereports.com/content/8/1/168
Семилетний мальчик поступил на стационарное лечение в связи с постоянными болями в спине в течение 2 месяцев, усиливающимися при ходьбе и исчезающими в покое.
Температура тела при поступлении была 37 °С. Рост ребенка составил 118 см, вес — 18,5 кг (дефицит массы тела).Сыпи, петехий и отеков конечностей не было обнаружено при осмотре, видимые слизистые оболочки бледно-розовые. Втяжения грудной клетки не было. Частота дыхания — 26 в минуту, при аускультации хрипов нет. Частота сердечных сокращений — 96 ударов в минуту, сердечных шумов не выслушивалось. Печень и селезенка не увеличены. В паховой области обнаружены увеличенные лимфатические узлы с обеих сторон, смещаемые, без признаков воспаления.
При общем анализе крови при поступлении было описано нормальное содержание лейкоцитов — 11,59×109/л, низкий уровень гемоглобина — 82 г/л, снижение количества тромбоцитов до 41×109/л, средний объем эритроцитов — 80,2 фл (норма). Данные соответствовали нормохромной анемии с тромбоцитопенией. По данным биохимического анализа крови, концентрации ионов кальция, натрия, калия, мочевой кислоты, общего билирубина, прямого билирубина, АлАТ, АсАТ и мочевины были в пределах возрастной нормы. Были несколько снижены уровни альбумина — 36,5 г/л (норма 38–54 г/л) и креатинина сыворотки — 36,24 мкмоль/л (норма 46–63 мкмоль/л). Концентрация железа сыворотки составила 24 мкмоль/л (норма 9,0–21,5 мкмоль/л), ферритина — 282,7 мкг/л (норма 7–140 мкг/л), общая железосвязывающая способность сыворотки — 38,1 мкмоль/л (норма 20–62 мкмоль/л). Уровни свободного тироксина, ТТГ и паратиреоидного гормона были в пределах возрастной нормы.
Был проведен дифференциальный диагноз между хроническим инфекционным процессом и апластической анемией. Туберкулиновый тест был отрицательным. При рентгенографии органов грудной клетки в прямой и боковой проекциях были обнаружены множественные компрессионные переломы грудных позвонков. На обзорной рентгенограмме костей таза были видны признаки остеопороза. При проведении магнитно-резонансной томографии грудного отдела позвоночника описаны множественные клиновидные и двояковогнутые деформации тел позвонков, а также жировое замещение костного мозга в остеопоротических областях (рис. 1). Пациенту было назначено лечение препаратами кальция в дозе 200 мг/сут.
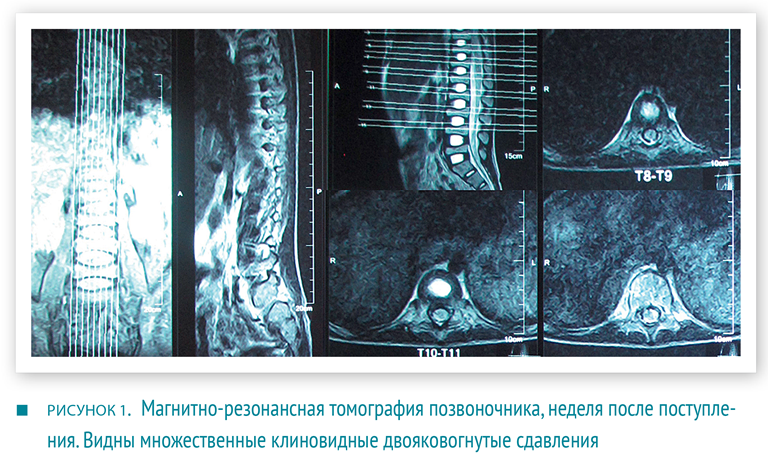
При сравнении рентгенограмм запястья пациента со стандартными было обнаружено отставание костного возраста. При денситометрии общая минеральная плотность костной ткани (МПКТ) составила 0,805 г/см2 и 97 % от возрастной нормы (Z-критерий = – 0,5 SD).
Через месяц в общем анализе крови наблюдалась панцитопения (лейкоциты — 3,54×109/л, гемоглобин — 99 г/л, тромбоциты — 37,2×109/л, средний объем эритроцитов — 86,4 фл (норма 75–87 фл)). По результатам гистологического исследования аспирата костного мозга был выявлен острый лимфобластный лейкоз (ОЛЛ), L2‑вариант.
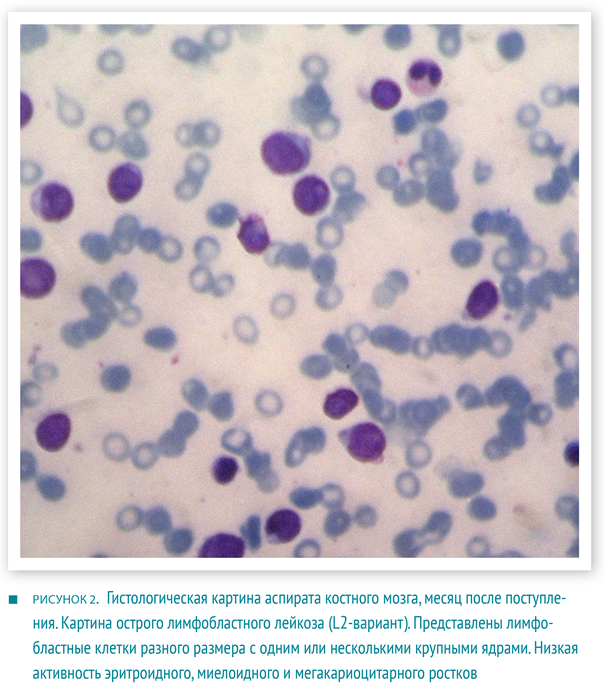
Основываясь на гистологических данных, был выставлен диагноз ОЛЛ, L2‑вариант. Больному была проведена программная химиотерапия в течение 109 недель, а также назначен прием препаратов кальция и витамина D для лечения вторичного остеопороза.
Обсуждение
Остеопороз — хроническое прогрессирующее обменное заболевание костной ткани или синдром при других заболеваниях; характеризуется снижением плотности костей, нарушением их структуры и увеличением хрупкости. Возникает в результате нарушения метаболизма костной ткани с преобладанием катаболизма над процессами костеобразования, снижением прочности кости и повышением риска переломов.
Остеопороз у детей может развиваться в результате врожденных генетических аномалий развития костей (первичный остеопороз), а также вследствие различных соматических заболеваний и медицинских процедур (вторичный остеопороз). Первичные формы относительно редки, в то время как вторичные состояния наблюдаются при многих хронических патологиях [3]. Среди этиологических факторов основную роль играют длительная иммобилизация, задержка полового развития и другие эндокринопатии, недостаточное питание и низкая масса тела, тяжелые хронические воспалительные заболевания и прием системных глюкокортикостероидов [2, 4].
Лейкозы — наиболее часто встречающаяся онкологическая патология у детей, среди них доля острого лимфобластного лейкоза (ОЛЛ) составляет около 75 %. При адекватной терапии прогноз этого заболевания у детей относительно благоприятен, общая выживаемость достигает 80 % [3]. Основные осложнения со стороны опорно-двигательного аппарата при лейкозе — это остеопороз и аваскулярный (асептический) некроз [5].
Описаны случаи развития остеопении и остеопороза как на момент постановки диагноза лейкоза, так и в процессе лечения и в течение 20 лет после его окончания [6]. Основными симптомами были мышечные боли, нарушения походки и осанки, переломы и задержка роста. Разными авторами описано 28 %-е увеличение 5‑летнего риска переломов у детей с ОЛЛ, они фиксируются у 25 % детей с острым лейкозом в течение терапии, а к моменту завершения лечения переломы случаются у 39 % детей с ОЛЛ [5, 7, 8].
Подсчитано, что частота переломов у детей с ОЛЛ в течение 12 месяцев после химиотерапии в 6 раз выше по сравнению с контрольной группой [9]. Костная масса часто бывает снижена к моменту установления диагноза и значительно снижается в течение первых 6 месяцев проведения химиотерапии [9, 10]. Факторами риска развития осложнений со стороны костно-мышечной системы являются плохое питание, ограничение подвижности, более старший возраст на момент постановки диагноза и мужской пол [5, 8].
В 2/3 случаев ОЛЛ у детей диагностируется менее чем за 4 недели от появления первых симптомов. Однако возможно и недиагностированное несколько месяцев течение ОЛЛ, при этом первые симптомы обычно неспеци-фичны и включают вялость, постоянную усталость, боли в костях и потерю аппетита. Более специфичные — анемия, геморрагический синдром и инфекции — появляются по мере вытеснения остатков нормального кроветворения бластными клетками [11].
Боли в костях при ОЛЛ могут быть результатом лейкемической инфильтрации костного мозга и надкостницы, остеонекрозов. В условиях нормального кроветворения сохраняется баланс между гемопоэтическими стволовыми клетками (ГСК) и компонентами костномозгового микроокружения, включающего остеобласты, остеокласты, мезенхимальные клетки и сосудистые структуры. При ОЛЛ остеопения обусловлена увеличением количества остеокластов и снижением активности остеобластов [12].
В описанном клиническом случае общая МПКТ была снижена на 0,5 SD. По данным исследований, снижение МПКТ до 1 SD ассоциировано с возрастанием риска переломов в 1,5–3 раза [6, 13]. С помощью инструментальных методов исследования были выявлены отставание костного возраста, компрессионные переломы грудных позвонков и признаки остеопороза.В описанном случае на фоне 50 %-й лимфобластной инфильтрации и гиперклеточности были угнетены все ростки нормального кроветворения.
При остром лейкозе увеличение количества бластных клеток приводит к экспансии остеокластов, осуществляющих резорбцию костной ткани, и снижению активности остеобластов. Связь других компонентов гемопоэтической «ниши» с развитием остеопороза остается недостаточно изученной [12].
Публикация клинического случая и сопутствующие иллюстрации осуществлялись с одобрения законных представителей больного. Копия подписанного информированного согласия находится у главного редактора журнала «Journal of medical case reports».
4080 просмотров
Поделиться ссылкой с друзьями ВКонтакте Одноклассники
Нашли ошибку? Выделите текст и нажмите Ctrl+Enter.

 Катрен Стиль
Катрен Стиль

зарегистрированным пользователям